おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。 まずは各法則の復習からです。
定比例の法則とは
定比例の法則とは、「ある化合物を構成する成分元素の質量比は,その製法の如何を問わず,常に一定である。」というものです。 【例】 例えば、炭素を燃焼させてできる二酸化炭素も,動物の呼吸中に含まれる二酸化炭素も,炭素と酸素の質量比は3:8です。例えば、CO2が88gのときCは24g、Oは64gなので24:64 = 3:8です。CO2が132gのときCは36g、Oは96gなので36:64 = 3:8です。 製法がどんなものであろうと、二酸化炭素はC原子1個とO原子2個からなるCO2です。詳細は定比例の法則を具体例でわかりやすく解説を参照してください。
倍数比例の法則とは
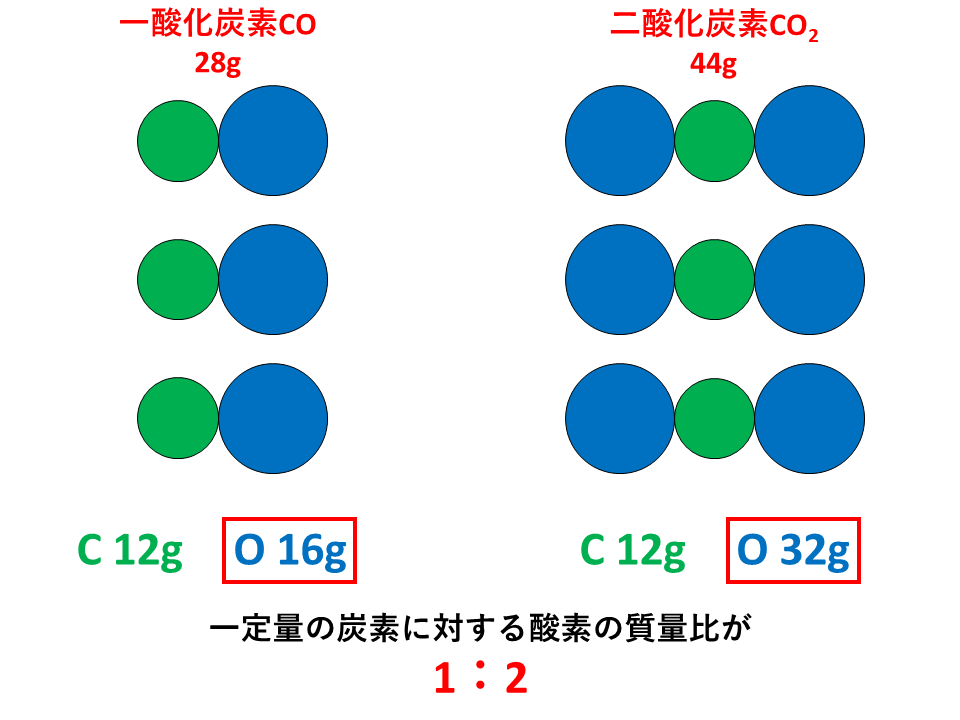
倍数比例の法則とは、「2種類の元素AとBが化合して,いくつかの異なる化合物を作るとき,一定質量のAとBの質量の間には,簡単な整数比が成り立つ。」というものです。 【例】 例えば、一酸化炭素28 gと二酸化炭素44 gは、それぞれ同量の炭素12 gを含んでいます。 (炭素の原子量C = 12 、酸素の原子量O = 16) 一酸化炭素28 g中の酸素は16 gであり、二酸化炭素44 g中の酸素は32 gとなります。 つまり、一定量の炭素を含む一酸化炭素と二酸化炭素それぞれに含まれる酸素の質量の比は、1:2 という比で表されます。これが倍数比例の法則です。詳細は倍数比例の法則を具体例でわかりやすく解説を参照してください。
それでは、各法則の違いと覚え方の解説に移ります。
定比例の法則・倍数比例の法則の違いと覚え方
上で見てきたように、定比例の法則は、1種類の化合物に含まれる成分元素の比例関係についての法則です。
これに対し、倍数比例の法則は、2種類以上の化合物内において、それぞれに共通した元素を比較し、そこに倍数の関係が成り立つという法則です。
つまり、
定…1種類
倍数…2種類以上
と覚えておけばよいのです。
倍数という言葉は、2つ以上数字がないと使えない言葉なので覚えられるはずです!頑張ってください。
なお、その他法則含めた覚え方は以下から。