【図解・画像・実験動画付き】入試にも頻出な同素体(硫黄・炭素・酸素・リン)と同位体はどのような違いがあるのでしょうか。それぞれの定義、性質、覚え方を図と実際の画像、実験動画を交えながら具体的かつ丁寧に解説します。
僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
同素体・同位体の概要
最初に同素体と同位体の定義を確認しましょう。
それでは一つ一つ見ていきましょう。
同位体とは
同位体の定義と解説
原子番号つまり陽子数は同じだが,中性子数が異なる原子同士のこと。
例えば、ウランUについて説明します。
ウランには、天然に3つの同位体が存在します。
この3つのウランは、同じ原子番号92番の”ウラン”ではあるけれど、質量数が違います。原子番号(=陽子数)は同じですが質量数は違うので、「中性子数が異なる」ということです。
※詳しくは化学|原子・分子・元素の違いと陽子・中性子・質量数・原子番号などを参照してください。

同位体は質量数が異なるだけで同じ元素であり,化学的性質はほぼ同じです。
この点が同素体と異なるのでテスト頻出です!気を付けましょう。
また、天然の多くの元素には同位体が存在していて,各元素の同位体の存在比はほぼ一定です。
放射性同位体と安定同位体
放射能をもち放射線を放つ同位体を,特に放射性同位体(ラジオアイソトープ)といい,
3H,14C,235Uなどがあります。これに対し,放射線を出さない安定な同位体を安定同位体といいます。放射性同位体は遺跡や化石の年代測定・医療などに利用されています。
同素体とは
同素体の定義と解説
同じ元素から成る性質や構造の異なる単体が2種類以上存在するとき,これらを同素体であるといいます。
S・・・斜方硫黄・単斜硫黄・ゴム状硫黄
C・・・ダイヤモンド・フラーレン・グラファイト(黒鉛)
O・・・酸素・オゾン
P・・・赤リン・黄リン
SCOPの4種類です。“スコップ”と覚えましょう。また、上に掲載している具体例は頻出のものだけをまとめていますので、こちらもすべて覚えましょう。
なお、そもそも化学で覚えておくべきことが整理できていない人は、おすすめ参考書に暗記事項がまとめてある教材もあるので、よければ参考にしてください。
硫黄の同素体
硫黄の単体には斜方硫黄、単斜硫黄、ゴム状硫黄の3種類があります。

出典:https://goukakunokotu.seesaa.net/
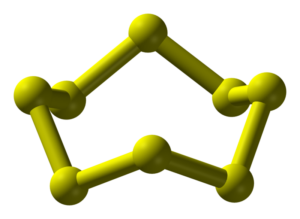
斜方硫黄
性質:黄色の塊状結晶

出典:https://ja.wikipedia.org/wiki/%E7%A1%AB%E9%BB%84
環状分子S8によって構成されています。
出典:https://ja.wikipedia.org/wiki/%E7%A1%AB%E9%BB%84
単斜硫黄
性質:黄色の針状結晶

出典:https://manabu-chemistry.com/archives/50215911.html
環状分子S8によって構成されています。
斜方硫黄もS8分子によって構成されていますが、温度によって安定する構造が異なるため違いが生じます。
ゴム状硫黄
性質:褐色のゴム状固体

出典:https://manabu-chemistry.com/archives/50215911.html
鎖状分子Sxによって構成されています。
炭素の同素体
黒鉛
黒色不透明で板状結晶です。自由電子が動くことができるため、電気伝導性があります。柔らかく、鉛筆に使われています。

出典:https://manabu-chemistry.com/archives/45678848.html
ダイヤモンド
無色透明で、共有結合性の八面体結晶です。極めて硬く、融点が高久、屈折率が大きいです。

出典:https://manabu-chemistry.com/archives/45678848.html
フラーレン
フラーレンC60はサッカーボール型をしています。その特異的な形から核反応を早くするといった性質や、水素化触媒といった性質を持っています。
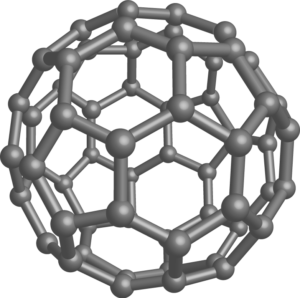
また、様々な化学的・物理的性質をもっているため、フラーレンの中に水分子を入れたり、フラーレンに化学修飾を施すことによって液状化させたり、多くの研究者によってフラーレンに関する研究が行われています。
酸素の同素体
酸素
酸素O2は、無色、無臭の気体です。空気中の21%を占めます。水に溶けにくく、燃焼によって酸化物を生じます。
オゾン
淡青色で、特異臭の気体です。不安定で分解しやすく、有毒です。地球上にはオゾン層として成層圏に存在しています。(以下画像は液体のオゾン)
-300x199.jpg)
リンの同素体
黄リン
黄リンは常温常圧において自然に酸素と反応し、自然発火します。そのため酸素のない水中で保存します。

赤リン
赤リンは比較的安定です。

マッチのこすられる方に使われています。
赤リンは自然発火しません。下の動画はリンの発火を撮影したものです。
同素体のまとめ
以下に同素体に関してまとめます。
| 元素名 | 元素記号 | 単体名 | 化学式 | 色 | 特性 |
|---|---|---|---|---|---|
| 硫黄 | S | 斜方硫黄 | S8 | 黄色 | 安定 |
| 単斜硫黄 | S8 | 黄色 | やや安定 | ||
| ゴム状硫黄 | Sx | 褐色 | 不安定 | ||
| 炭素 | C | 黒鉛(グラファイト) | C | 黒 | もろい(薄くはがれやすい) 電気伝導性あり |
| ダイヤモンド | C | 無色透明 | 非常に固い 電気伝導性なし |
||
| フラーレン | C60 | ||||
| 酸素 | O | 酸素 | O2 | 無色 | 無臭 |
| オゾン | O3 | 淡青色 | 特異臭 | ||
| リン | P | 黄リン | P4 | 黄色 | 自然発火、水中保存 |
| 赤リン | Px | 赤色 | 安定 |
同素体と同位体の違いの覚え方
漢字で覚えましょう。
同素体は、「同じ元素」からできているということ⇒性質や構造が異なる
同位体は、「同じ順位(原子番号=陽子数)」ということ⇒中性子数が異なる
正誤問題がよく出題されるので、必ず覚えておきましょう。
さいごに
同素体と同位体の違いはわかりましたか?
化学の学習においては、覚えないといけないこと、覚えなくても考えて導くことの区別をつけておくことで、学習の効率がアップします。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。暗記に使える参考書も紹介しています。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。


.png)