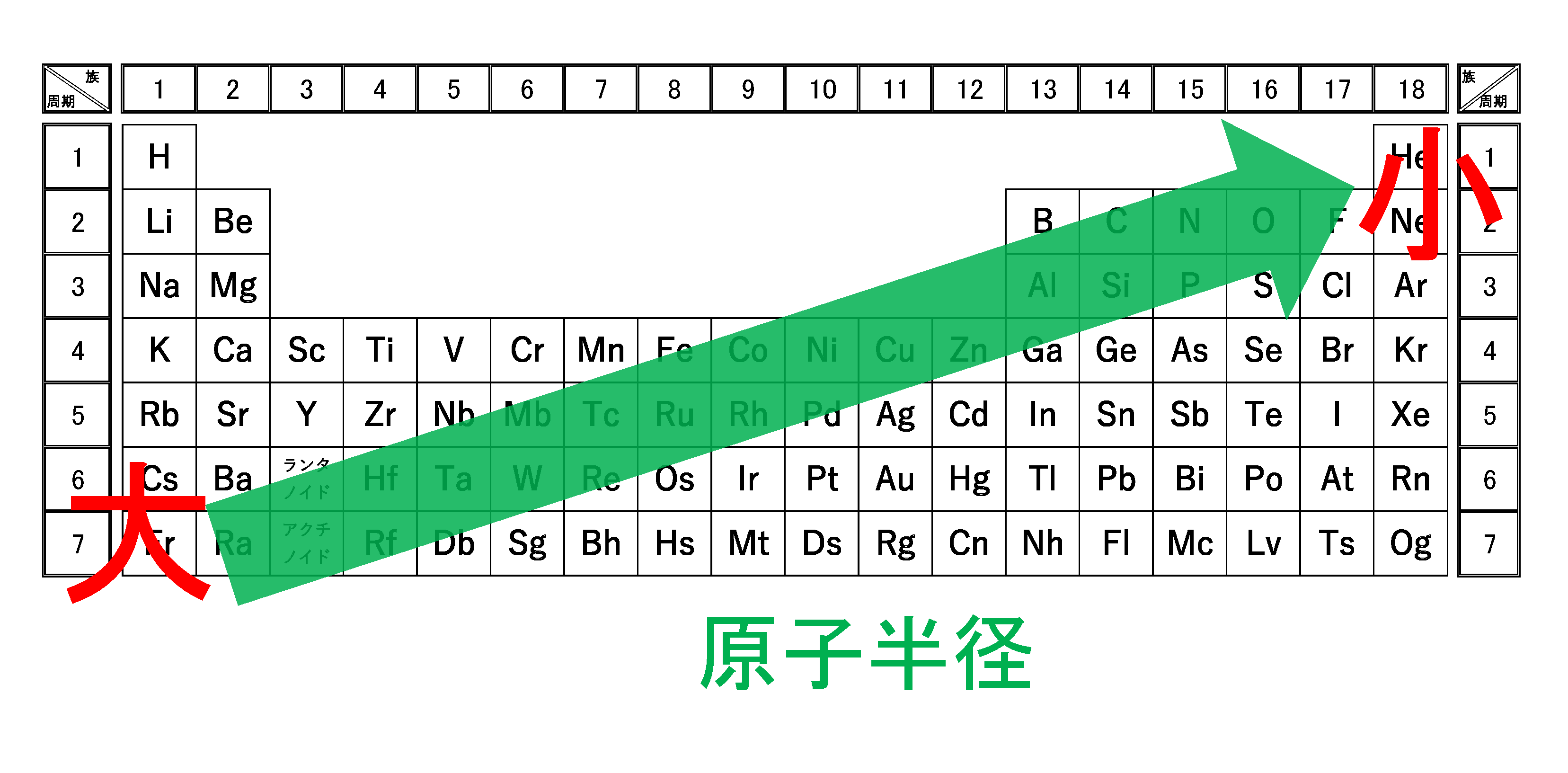
イオン半径(イオンの大きさ)の比較も、イオン化エネルギーや電子親和力、電気陰性度や原子半径と同様に「電子を引きつける強さ」をもとに、同じように統一して考えることができます。本記事ではイオン半径の大小の理由を中心に、希ガスとの比較が無意味である理由についても解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
イオン半径とは
イオン半径とは、 陽イオンや陰イオンを球形とみなしたときの半径のことです。
高校レベルでは、原子半径と同様に中心にある原子核から最外殻電子までのキョリと考えて良いです。
ポイントとなるのは、希ガスの電子配置ごとに考えることです。
イオン半径の同族での比較
同族の同じ価数のイオンでは,周期表で下のものほど半径は大きいです。
なぜなら周期表の下の方のイオンの方が、より外側に最外殻をもつので、半径が大きくなります。
具体的には、
Na+< K+ ,Mg2+< Ca2+
などです。
電子配置が同じイオンの大きさの比較
電子配置が同じイオンの場合はどうでしょうか。
電子配置が同じとしても中心の原子核に含まれる陽子数は違います。
陽子数が多ければ多いほど、周りの電子を引き付けようとする引力が強くなります。
そうすると、陽子数つまり原子番号が大きいイオンの方が回りの電子を“グッ”と引きつけ、イオン半径は小さくなるはずです。
頻出の比較は以下の2パターンです。
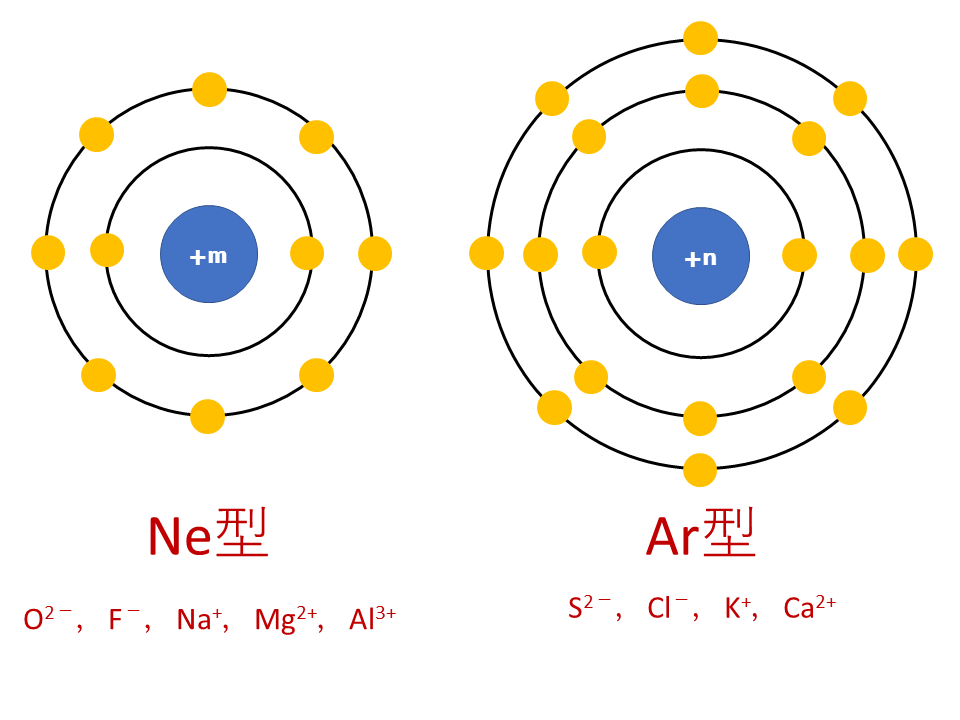
Ne型電子配置を取るイオンの大きさの比較
まずはNe型電子配置を取るイオンの比較です。
![同じ電子配置のイオン半径の比較[Ne型]](https://science-stock.com/wp-content/uploads/2021/04/c1106d8872bd2d8fd1b1a56611ff6b54-1024x576.png)
O2-,F-,Na+,Mg2+,Al3+はすべてNeと同じ電子配置【K殻2個,L殻8個】です。しかし、中心にある原子核中に含まれる陽子数は異なります。
O2-は8個,F-は9個,Na+は11個,Mg2+は12個,Al3+は13個の陽子を含んでおり、陽子数が多いほど周りの電子を“グッ”と引き付けイオン半径は小さくなります。
よって、イオンの大きさは、O2- > F- > Na+ > Mg2+ > Al3+となります。
Ar型電子配置を取るイオンの大きさの比較
まずはAr型電子配置を取るイオンの比較です。
![同じ電子配置のイオン半径の比較[Ar型]](https://science-stock.com/wp-content/uploads/2021/04/d1226895e4238e3de182d1b1d3770dca-1024x576.png)
S2-,Cl-,K+,Ca2+はすべてArと同じ電子配置【K殻2個,L殻8個,M殻8個】です。しかし、中心にある原子核中に含まれる陽子数は異なります。
S2-は16個,Cl-は17個,K+は19個,Ca2+は20個の陽子を含んでおり、陽子数が多いほど周りの電子を“グッ”と引き付けイオン半径は小さくなります。
よって、イオンの大きさは、S2- > Cl- > K+ > Ca2+ となります。
今までの解説から、O2- > F- > Ne > Na+ > Mg2+ > Al3+であったり、S2- > Cl- > Ar > K+ > Ca2+となるのではないかと予想する人もいます。しかし、現実には比べることが困難です。そもそも半径の測定方法は、分子や結晶などの結合状態から測定する方法がメジャーです。そうすると、イオンの場合はイオン結合から算出される半径であり、原子の場合は分子間力(ファンデルワールス力)から算出される半径であったりと、種類によって異なります。すると、イオン結合とファンデルワールス力の結合力の大きさに差異がある以上、合理的な数値にはなりません(今回の場合、ファンデルワールス力がかなり弱いため、結合距離が長くなってしまい、希ガスの半径がイオン半径からすると異常に大きくなってしまいます)。そのため、入試問題で出題しづらいのです。
イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径について
根本的な考え方が同じである「イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径」についての他記事は以下を参照ください。
さいごに
イオン半径も原子半径同様、出題頻度はイオン化エネルギーに比べると落ちます。
しかし、考え方はイオン化エネルギー・電子親和力・原子半径・イオン半径ともに一貫しているので、すべて自分で説明できるレベルまで内容を消化しておいてください。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。