【覚え方のコツ付き】受験で必要な陽イオン・陰イオンの化学式、名称、価数は覚える量が多いです。本記事では受験で必要な全てのイオン式一覧と、覚える労力を10分の1に減らすコツを紹介します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
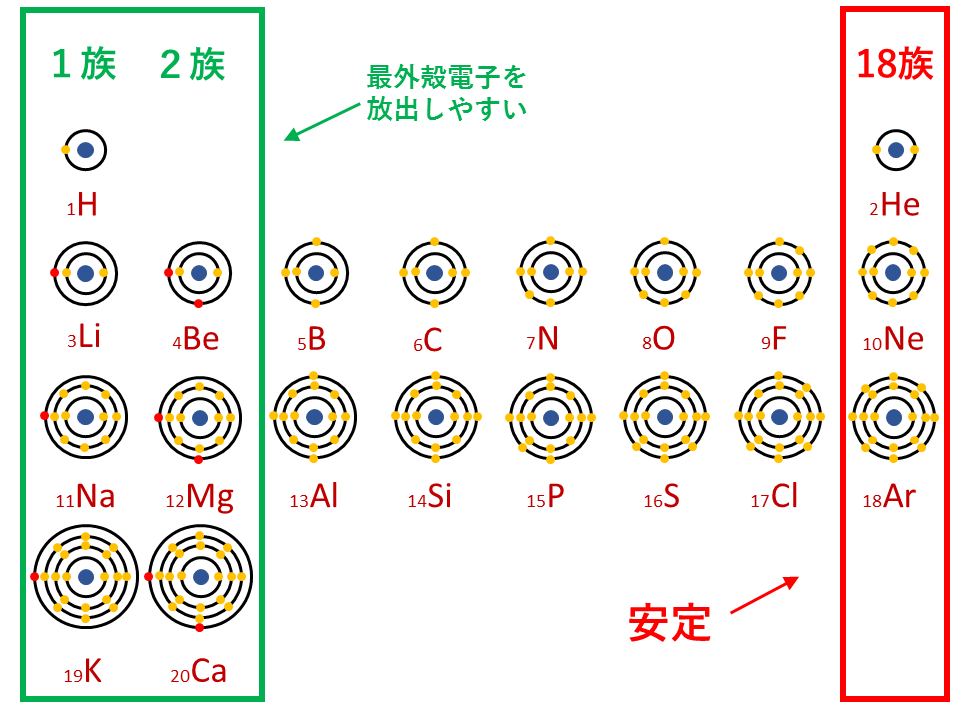
単原子イオン
典型元素のイオン式
単原子イオンの考え方と覚え方は陽イオン・陰イオン(単原子イオン)の電子配置と価数を参照。
遷移元素のイオン式
価数は複数存在するものもあり、基本的に覚えるしかありません。
多原子イオン
多原子イオンとは複数の原子が結合した「原子団」に電子が結合したり取れたりしてできたイオンのことです。アンモニウムイオンNH4+のみ陽イオンで他はすべて陰イオンです。例えば、SO42ーなどがあります。
SO42ーでいうと、S原子が1個、O原子が4個が結合し、合計でマイナス2の電荷(価数)をもつという意味合いです。つまり、右上の数字は価数、右下の数字は該当の原子の個数を表しています。
錯イオン
追々別の記事で執筆します。
イオン式の一覧
入試に出題される暗記必須のイオンを以下にまとめました。
| 価数 | イオン式 | 名称 | |
|---|---|---|---|
| 1 | H+ | 水素イオン | 1族なので1価 |
| 1 | Li+ | リチウムイオン | |
| 1 | Na+ | ナトリウムイオン | |
| 1 | K+ | カリウムイオン | |
| 2 | Mg2+ | マグネシウムイオン | 2族なので2価 |
| 2 | Ca2+ | カルシウムイオン | |
| 2 | Ba2+ | バリウムイオン | |
| 2 | Zn2+ | 亜鉛イオン | * |
| 3 | Al3+ | アルミニウムイオン | 覚える! |
| 2 | Pb2+ | 鉛(Ⅱ)イオン | * |
| 3 | Cr3+ | クロム(Ⅲ)イオン | 覚える! |
| 2 | Mn2+ | マンガン(Ⅱ)イオン | * |
| 2 | Fe2+ | 鉄(Ⅱ)イオン | 覚える! |
| 3 | Fe3+ | 鉄(Ⅲ)イオン | |
| 2 | Ni2+ | ニッケル(Ⅱ)イオン | * |
| 1 | Cu+ | 銅(Ⅰ)イオン | 覚える! |
| 2 | Cu2+ | 銅(Ⅱ)イオン | |
| 1 | Ag+ | 銀イオン | 覚える! |
| 1 | NH4+ | アンモニウムイオン | アンモニアNH3にH+が付いた |
| 1 | Fー | フッ化物イオン | 17族なので1価 |
| 1 | Clー | 塩化物イオン | |
| 1 | Brー | 臭化物イオン | |
| 1 | Iー | ヨウ化物イオン | |
| 2 | O2ー | 酸化物イオン | 16族なので2価 |
| 2 | S2ー | 硫化物イオン | |
| 1 | OHー | 水酸化物イオン | |
| 1 | CNー | シアン化物イオン | |
| 1 | SCNー | チオシアン酸イオン | 「チオ」は硫黄の意味 |
| 2 | CO32ー | 炭酸イオン | H2CO3 → HCO3- + H+ HCO3- → CO32- + H+ |
| 1 | HCO3ー | 炭酸水素イオン | |
| 1 | CH3COOー | 酢酸イオン | |
| 2 | C2O42ー | シュウ酸イオン | (COO)22ーでもOK |
| 1 | NO2ー | 亜硝酸イオン | 「亜」が付くとOが減る |
| 1 | NO3ー | 硝酸イオン | |
| 2 | SO32ー | 亜硫酸イオン | 「亜」が付くとOが減る |
| 2 | SO42ー | 硫酸イオン | H2SO4 → HSO4- + H+ HSO4- → SO42- + H+ |
| 1 | HSO4ー | 硫酸水素イオン | |
| 2 | S2O32ー | チオ硫酸イオン | チオなのでOをSに一つ置換え |
| 3 | PO43ー | リン酸イオン | H3PO4 → H2PO4ー + H+ H2PO4ー → HPO42- + H+ HPO42- → PO43ー + H+ |
| 2 | HPO42ー | リン酸一イオン | |
| 1 | H2PO4ー | リン酸二イオン | |
| 1 | ClOー | 次亜塩素酸イオン | 「次亜」でOが2つ減る |
| 1 | ClO2ー | 亜塩素酸イオン | 「亜」が付くとOが減る |
| 1 | ClO3ー | 塩素酸イオン | |
| 1 | ClO4ー | 過塩素酸イオン | 「過」が付くとOが増える |
| 1 | MnO4ー | 過マンガン酸イオン | |
| 2 | CrO42ー | クロム酸イオン | |
| 2 | Cr2O72ー | ニクロム酸イオン |
*1族と2族以外の陽イオンに関しては、価数が1と3のイオンだけを覚えてあとは全て価数2と覚えれば良いです。
次は覚えるべき錯イオンです。
| 名称 | イオン式 |
|---|---|
| ジアンミン銀(Ⅰ)イオン | [Ag(NH3)2]+ |
| テトラアンミン銅(Ⅱ)イオン | [Cu(NH3)4]2+ |
| テトラアンミン亜鉛イオン | [Zn(NH3)4]2+ |
| テトラヒドロキシド亜鉛酸イオン | [Zn(OH)4]2ー |
| テトラヒドロキシドアルミン酸イオン | [Al(OH)4]ー |
| ヘキサシアニド鉄(Ⅱ)酸イオン | [Fe(CN)6]4ー |
| ヘキサシアニド鉄(Ⅲ)酸イオン | [Fe(CN)6]3ー |
| ビス(チオスルファト)銀(Ⅰ)酸イオン | [Ag(S2O3)2]3ー |
さいごに
イオンはほぼ全分野全単元に影響する単元です。
上記で書いているイオンは絶対に覚えてください。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。