【図解】単原子イオンの陽イオン・陰イオンはどのようにして出来ているのでしょうか。結論は安定な電子配置をとっている希ガスと同じになりたいからなのですが、その詳しい理由や価数の考え方、覚え方について具体的かつ丁寧に解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
単原子イオン
原子から電子(マイナス)が取れるとプラスに帯電し陽イオンに、原子が電子(マイナス)を取り込むとマイナスに帯電し陰イオンになります。
これらは、1個の原子からできたイオンなので単原子イオンといいます。
それでは詳しく見ていきましょう。
陽イオン
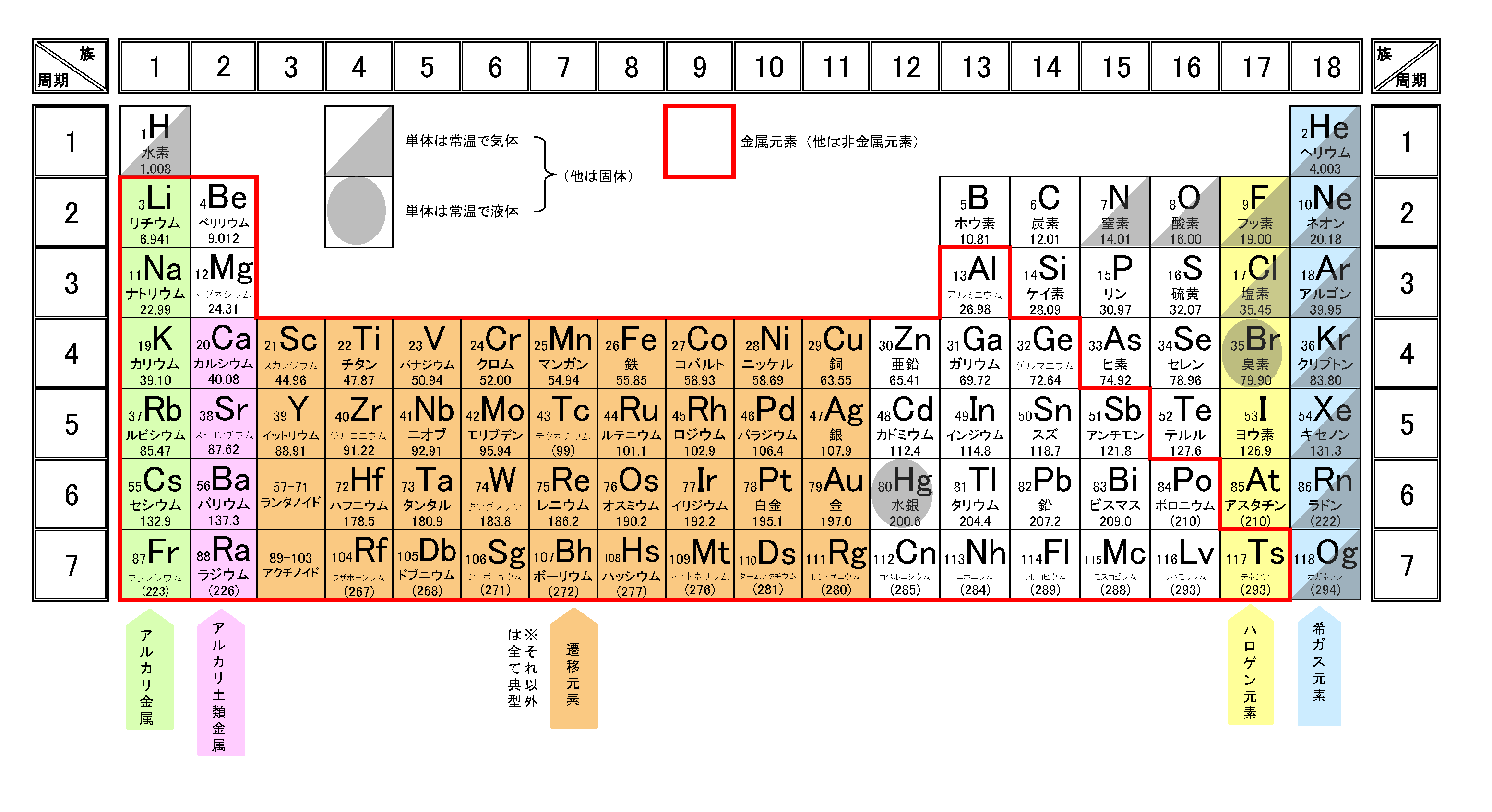
希ガス(18族)の電子配置は閉殻またはオクテットであるため安定的なので、1族や2族など、周期表で18族の電子配置に近い原子は安定化するために原子番号の最も近い希ガスの電子配置になろうとします。
ちなみに陽イオン(単原子イオン)の名称は、「元素名+イオン」となります。
※電子配置の話を忘れた人は電子配置の書き方を解説!一覧(周期表)付きを参照
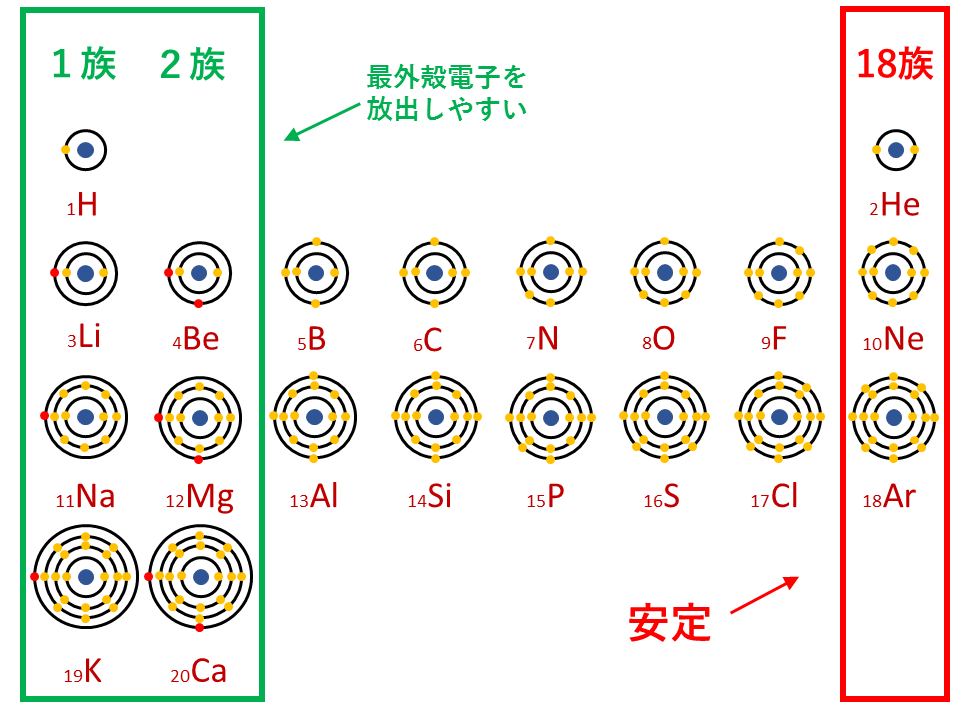
1族や2族に該当するナトリウムNaやカルシウムCaなどは、最外殻電子が1個や2個存在します。18族である希ガスの電子配置は安定的なため、そこに電子を一つや二つ加えただけの1族や2族は簡単に最外殻電子を1個または2個放出でき、一価の陽イオン(Na+)や二価の陽イオン(Ca2+)などになります。
例えば、
ナトリウムイオンの電子配置
Na → Na+ + e-
これを電子配置図で表すと次のようになります。
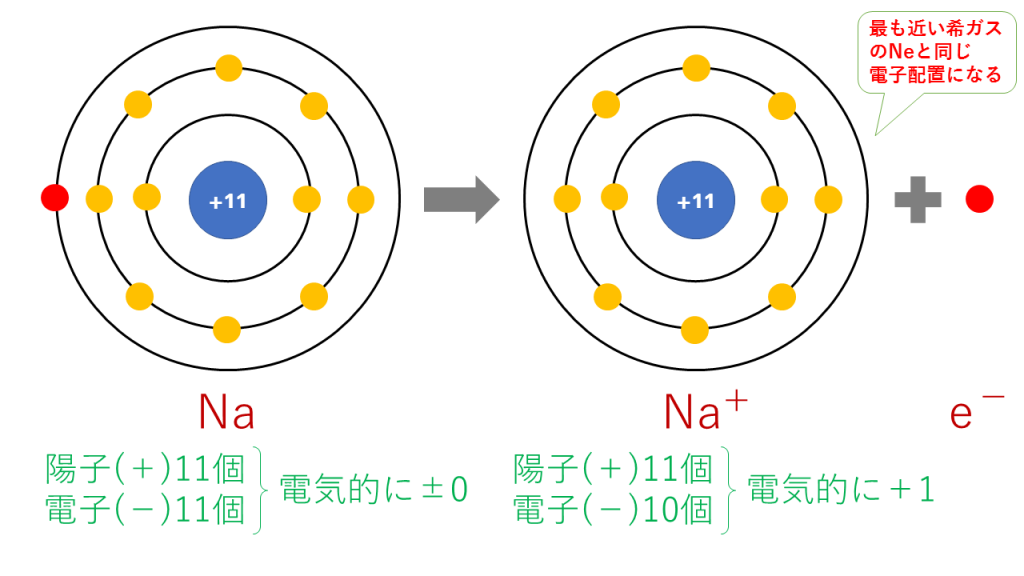
最終的に、Na(11番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。
陽子は11個で変わらないのに対し、電子は10個に減少したため、一つだけプラスが多くなり、Na+となります。
カリウムイオンの電子配置
K → K+ + e-
これを電子配置図で表すと次のようになります。
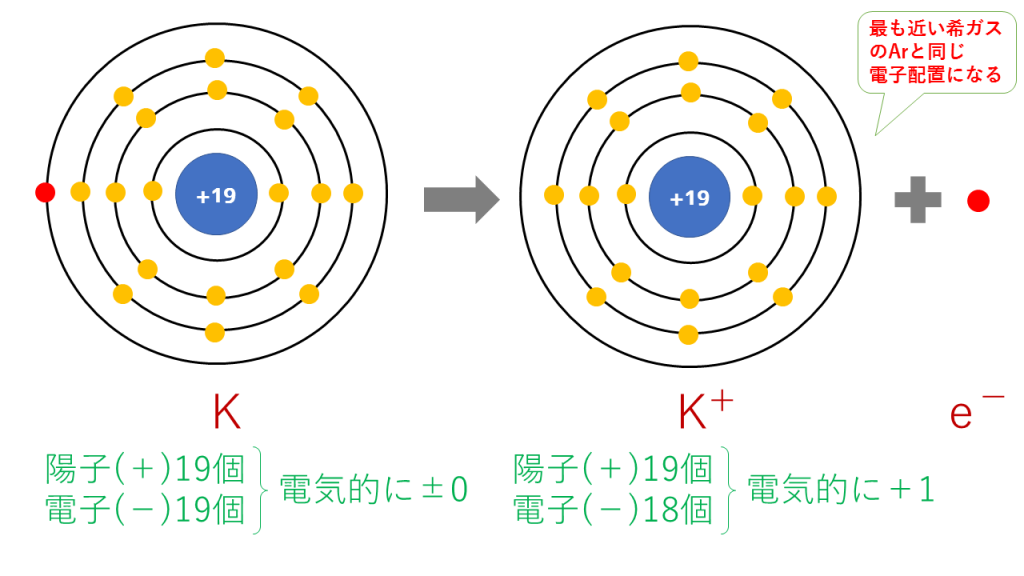
最終的に、K(19番)と原子番号が最も近い希ガスのAr(18番)と同じ電子配置となります。
陽子は19個で変わらないのに対し、電子は18個に減少したため、一つだけプラスが多くなり、K+となります。
マグネシウムイオンの電子配置
Mg → Mg2+ + 2e-
これを電子配置図で表すと次のようになります。
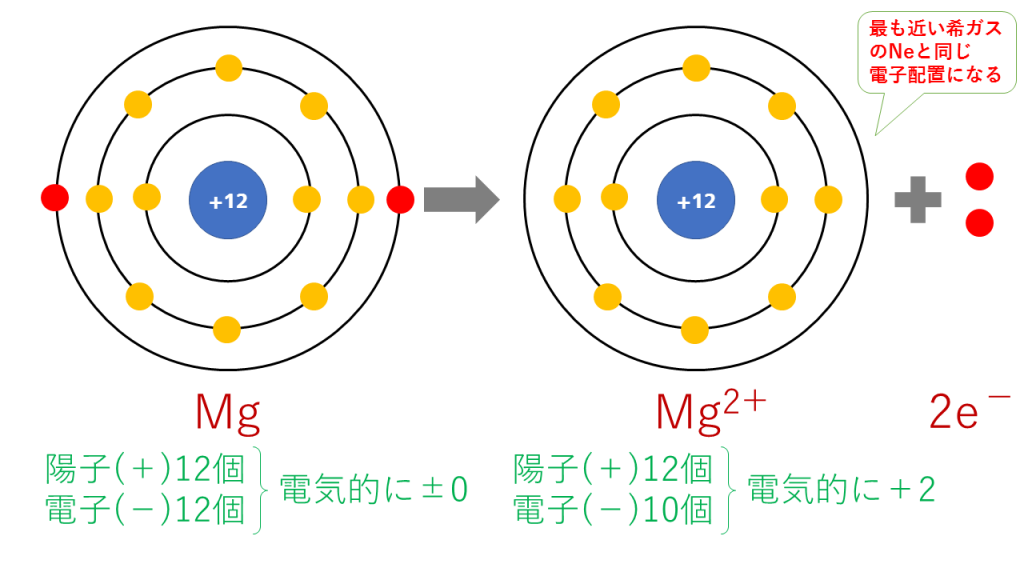
最終的に、Mg(12番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。
陽子は12個で変わらないのに対し、電子は10個に減少したため、二つだけプラスが多くなり、Mg2+となります。
カルシウムイオンの電子配置
Ca → Ca2+ + 2e-
これを電子配置図で表すと次のようになります。
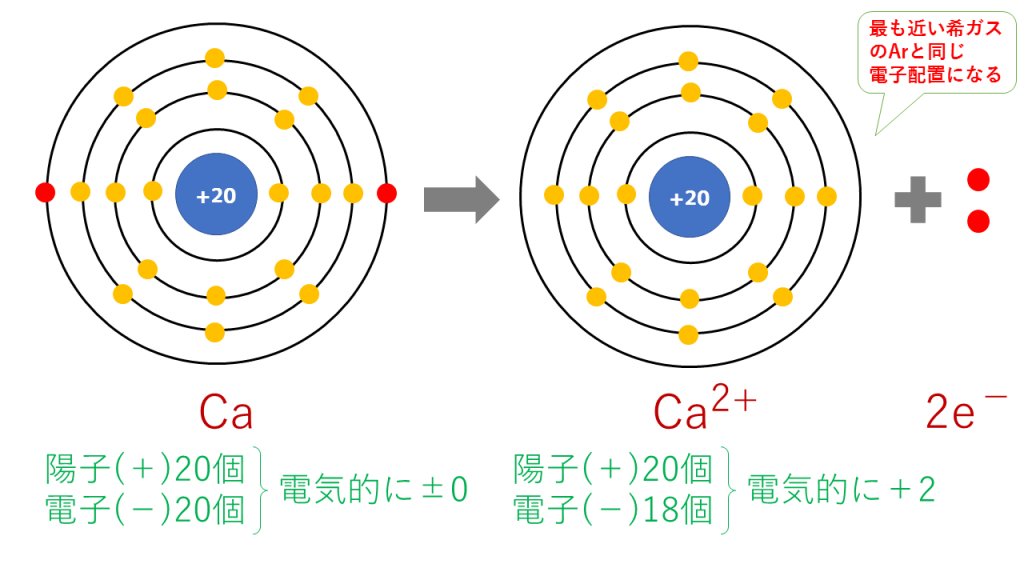
最終的に、Ca(20番)と原子番号が最も近い希ガスのAr(18番)と同じ電子配置となります。
陽子は20個で変わらないのに対し、電子は18個に減少したため、二つだけプラスが多くなり、Ca2+となります。
アルミニウムイオンの電子配置
Al → Al3+ + 3e-
これを電子配置図で表すと次のようになります。
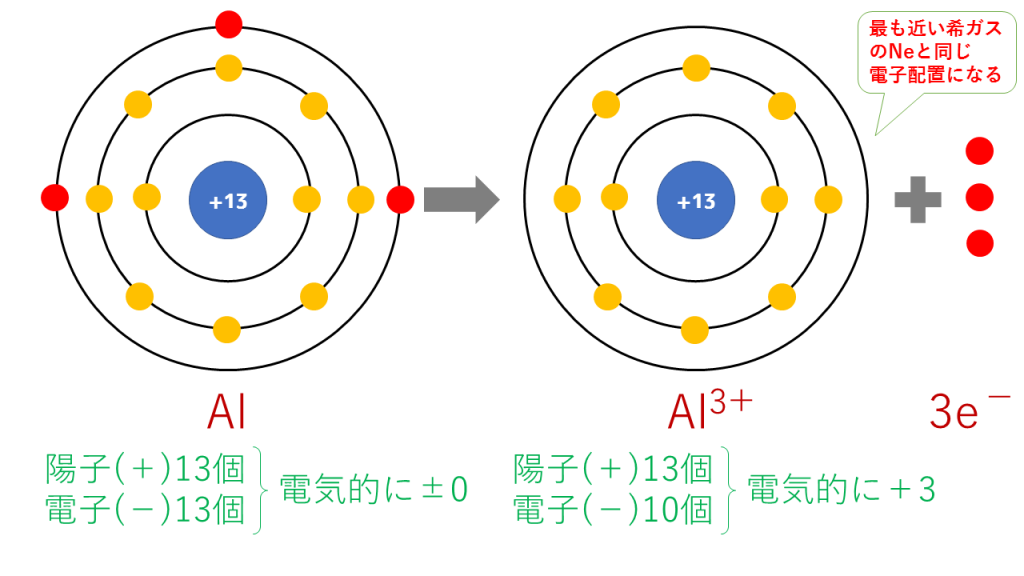
最終的に、Al(13番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。
陽子は13個で変わらないのに対し、電子は10個に減少したため、三つだけプラスが多くなり、Al3+となります。
陰イオン
希ガス(18族)の電子配置は閉殻またはオクテットであるため安定的なので、16族や17族など、周期表で18族の電子配置に近い原子は安定化するために原子番号の最も近い希ガスの電子配置になろうとします。
ちなみに陰イオン(単原子イオン)の名称は、「~化物イオン」となります。
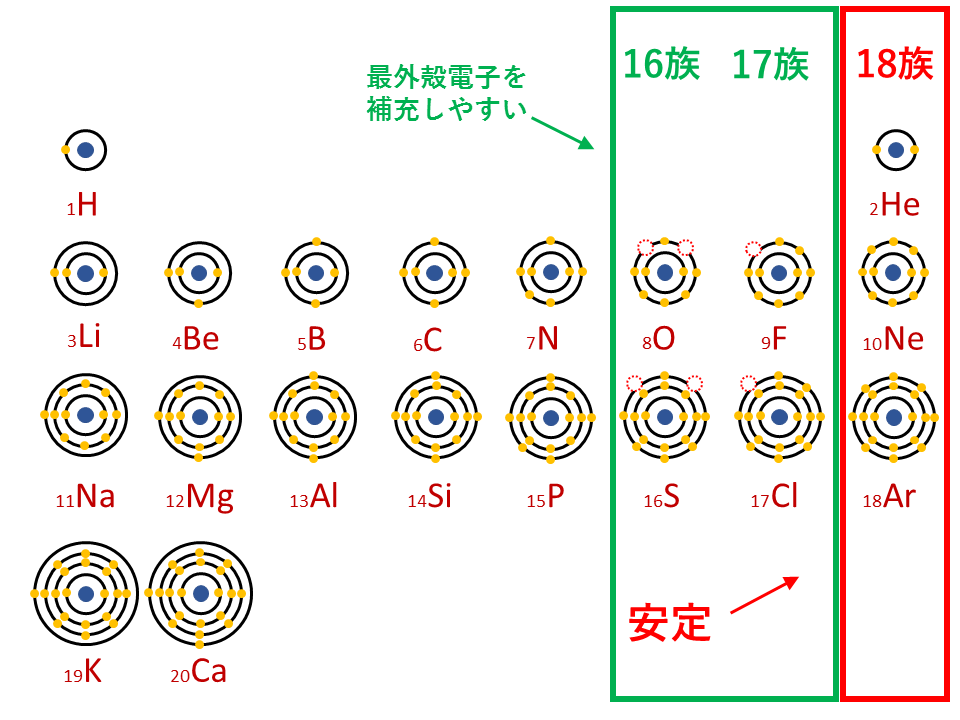
16族や17族に該当する酸素Oや塩素Clなどは、最外殻電子が6個や7個存在します。18族である希ガスの電子配置は安定的なため、電子が一つや二つ足りないだけの16族や17族は簡単に最外殻電子を1個または2個補充でき、一価の陰イオン(Cl-)や二価の陰イオン(O2-)などになります。
例えば、
フッ化物イオンの電子配置
F + e- → F-
これを電子配置図で表すと次のようになります。
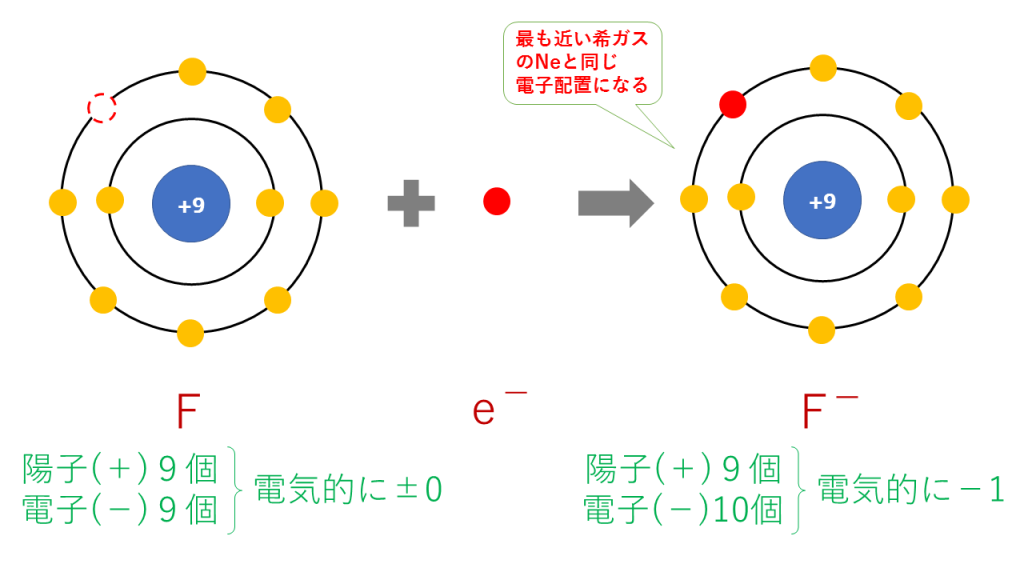
最終的に、F(9番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。
陽子は9個で変わらないのに対し、電子は10個に増加したため、一つだけマイナスが多くなり、F-となります。
塩化物イオンの電子配置
Cl + e- → Cl-
これを電子配置図で表すと次のようになります。
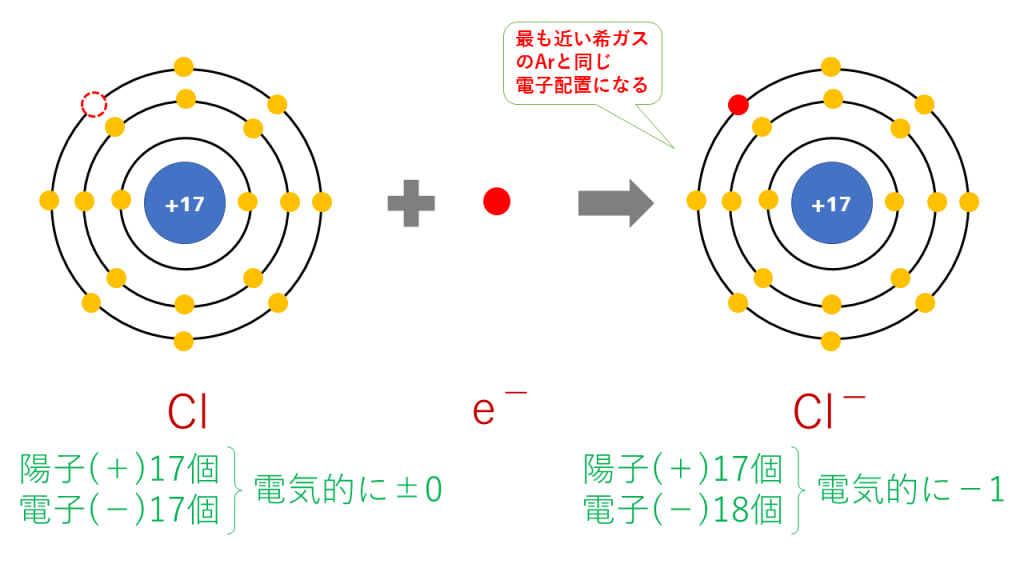
最終的に、Cl(17番)と原子番号が最も近い希ガスのAr(18番)と同じ電子配置となります。
陽子は17個で変わらないのに対し、電子は18個に増加したため、一つだけマイナスが多くなり、Cl-となります。
酸化物イオンの電子配置
O + 2e- → O2-
これを電子配置図で表すと次のようになります。
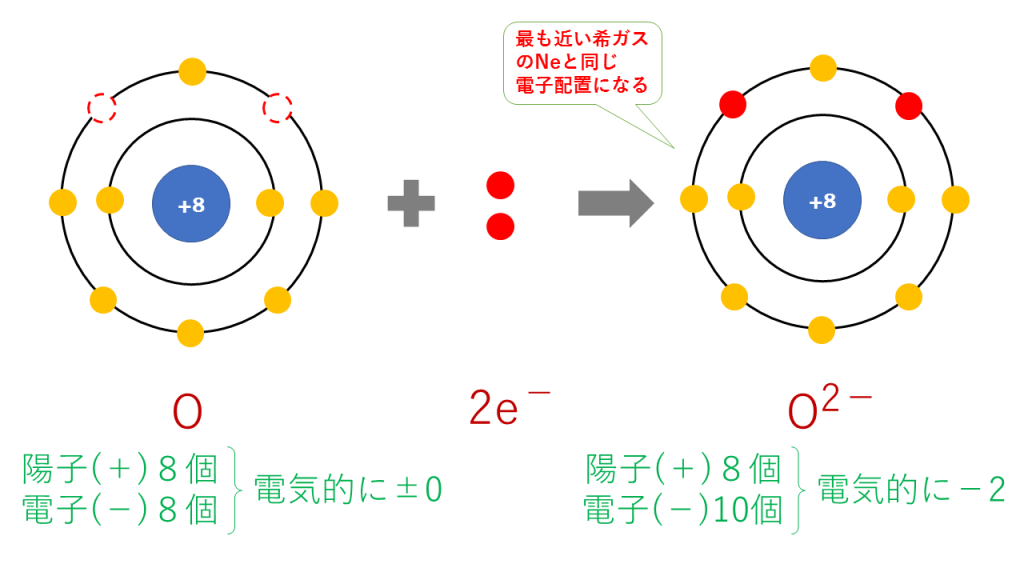
最終的に、O(8番)と原子番号が最も近い希ガスのNe(10番)と同じ電子配置となります。
陽子は8個で変わらないのに対し、電子は10個に増加したため、二つだけマイナスが多くなり、O2-となります。
硫化物イオンの電子配置
S + 2e- → S2-
これを電子配置図で表すと次のようになります。
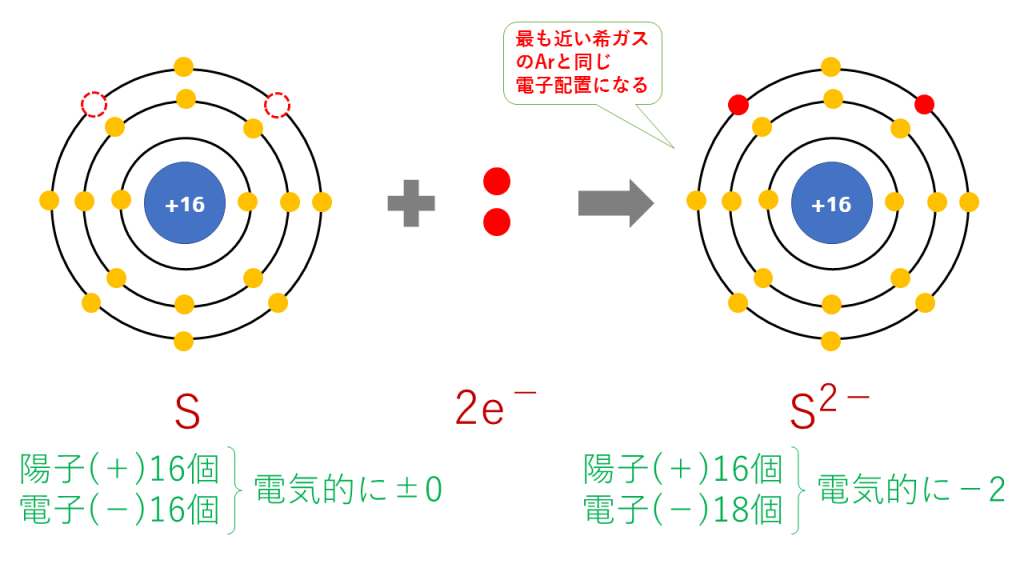
最終的に、S(16番)と原子番号が最も近い希ガスのAr(18番)と同じ電子配置となります。
陽子は16個で変わらないのに対し、電子は18個に増加したため、二つだけマイナスが多くなり、S2-となります。
イオン式と価数の覚え方
これまで見てきた通り、単原子イオンはK+,S2-のように元素記号の右上に電荷を書いたイオン式で表します。
このとき、右上の電荷のことをそのイオンの価数といいます。
K+であれば一価の陽イオン、S2-であれば2価の陰イオンと表します。
つまり、
2族は価数2の陽イオンになります(例:Mg2+,Ca2+)。
13族は価数3の陽イオンになります(例:Al3+)。
16族は価数2の陰イオンになります(例:O2-,S2-)。
17族は価数1の陰イオンになります(例:F-,Cl-)。
※13族は高校範囲ではアルミニウムイオンAl3+のみ出題されます。
それ以外はすべて周期表の縦(族)を覚えておけば価数が対応して覚えられます。
縦の覚え方は周期表の覚え方と族(縦)や周期(横)の見方を参照
覚えるべきイオンの一覧は、受験で覚えておくべき単原子イオン・多原子イオンの一覧を参照
陽性と陰性
原子が陽イオンになろうとする性質のことを陽性、陰イオンになろうとする性質のことを陰性といいます。
陽性が高い元素は周期表の左側の方でナトリウムNaやカリウムKなどが該当します。
陰性が高い金属は周期表の右側の方でフッ素Fや塩素Clなどが該当します。
さいごに
典型元素の場合、周期表の族でイオンの価数が決まることを覚えておいてください。
慣れてくれば、すぐに思い出せますが、それまでは繰り返し暗記しましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。