おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
第一イオン化エネルギーとは
「原子から電子を一つ取り除いて一価の陽イオンになるときに必要なエネルギー」です。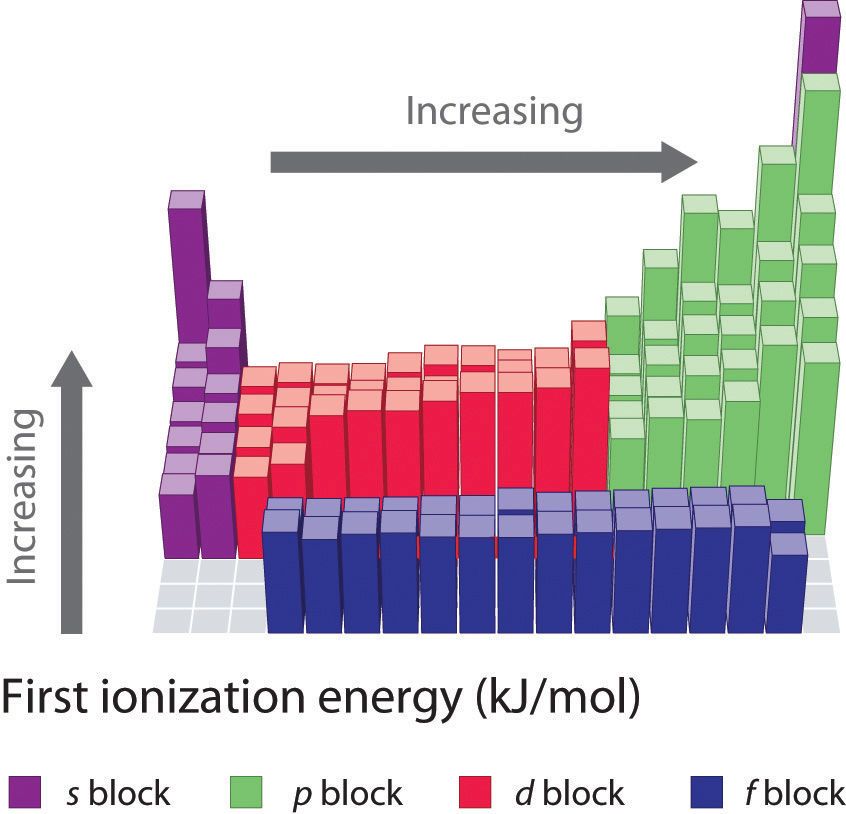 出典:https://chemwiki.ucdavis.edu/
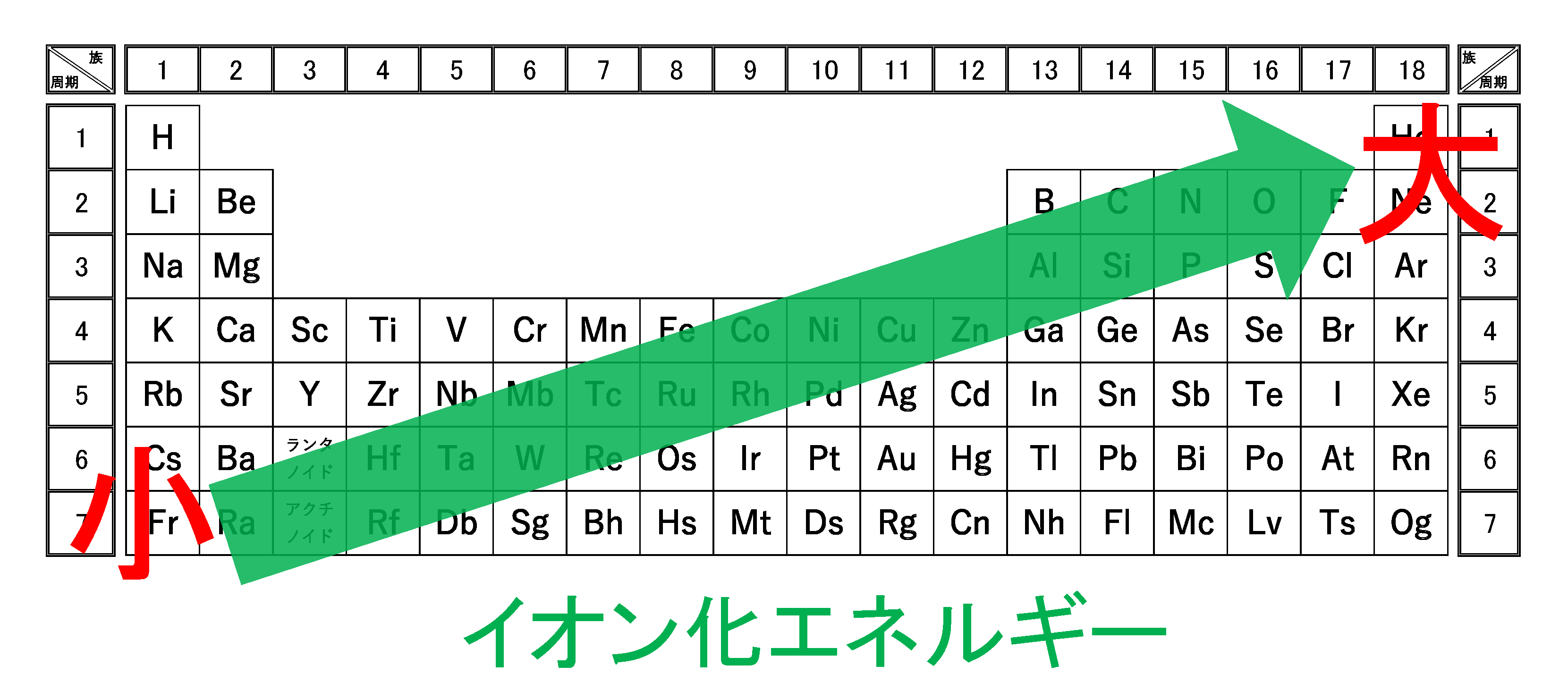
そしてその大きさは周期表の「右上」が最大であり、「左下」が最小です。
「電子の引きつけ度合い」と理解しておくと、その理由がわかります。
それでは、細かく見ていきましょう。
出典:https://chemwiki.ucdavis.edu/
そしてその大きさは周期表の「右上」が最大であり、「左下」が最小です。
「電子の引きつけ度合い」と理解しておくと、その理由がわかります。
それでは、細かく見ていきましょう。
イオン化エネルギーは電子の引きつけ度合い
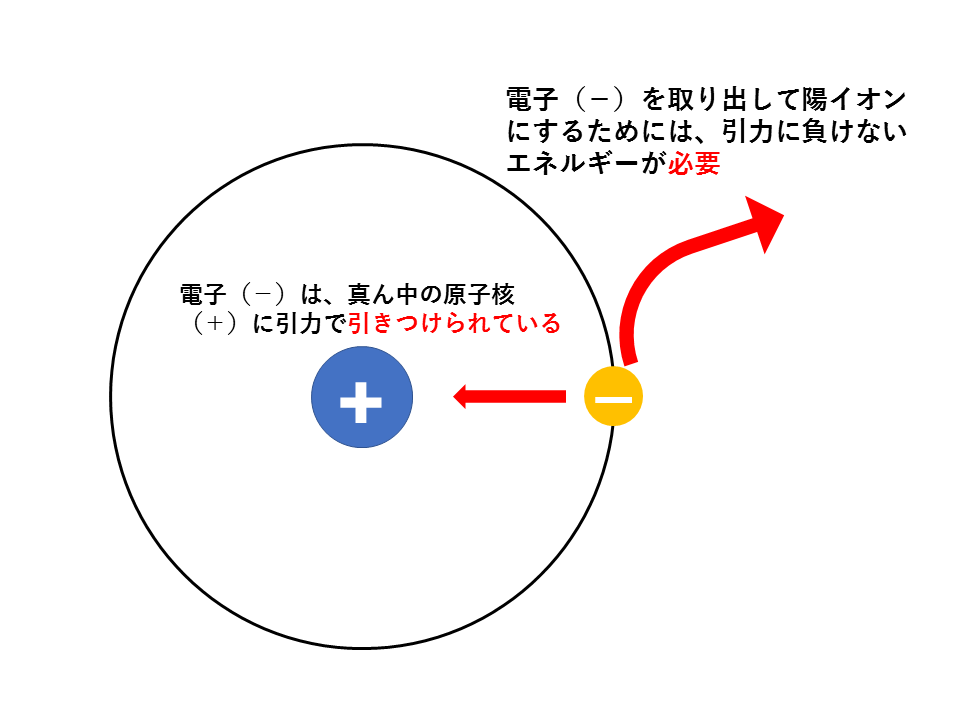 イオン化エネルギーとは「原子から電子を一つ取り除いて一価の陽イオンになるときに必要なエネルギー」です。つまり、原子から電子を取り出す必要があります。
そもそも原子核には陽子(+)が含まれているため、周りをまわっている電子(-)は原子核に引きつけられています。電子を取り出し、陽イオンにするためには、その引力に負けないだけのエネルギーが必要となります(エネルギーを吸収する必要があります)。
つまり、原子核(+)が回りの電子を引き付ける引力が強いほど、陽イオンになるときにはたくさんのエネルギーが必要ということになります。
要するにたくさんのエネルギーを吸収しないと陽イオンになれないということです。
このため、イオン化エネルギーが大きい原子は、周りの電子を引き付ける引力が強いのです。
イオン化エネルギーとは「原子から電子を一つ取り除いて一価の陽イオンになるときに必要なエネルギー」です。つまり、原子から電子を取り出す必要があります。
そもそも原子核には陽子(+)が含まれているため、周りをまわっている電子(-)は原子核に引きつけられています。電子を取り出し、陽イオンにするためには、その引力に負けないだけのエネルギーが必要となります(エネルギーを吸収する必要があります)。
つまり、原子核(+)が回りの電子を引き付ける引力が強いほど、陽イオンになるときにはたくさんのエネルギーが必要ということになります。
要するにたくさんのエネルギーを吸収しないと陽イオンになれないということです。
このため、イオン化エネルギーが大きい原子は、周りの電子を引き付ける引力が強いのです。
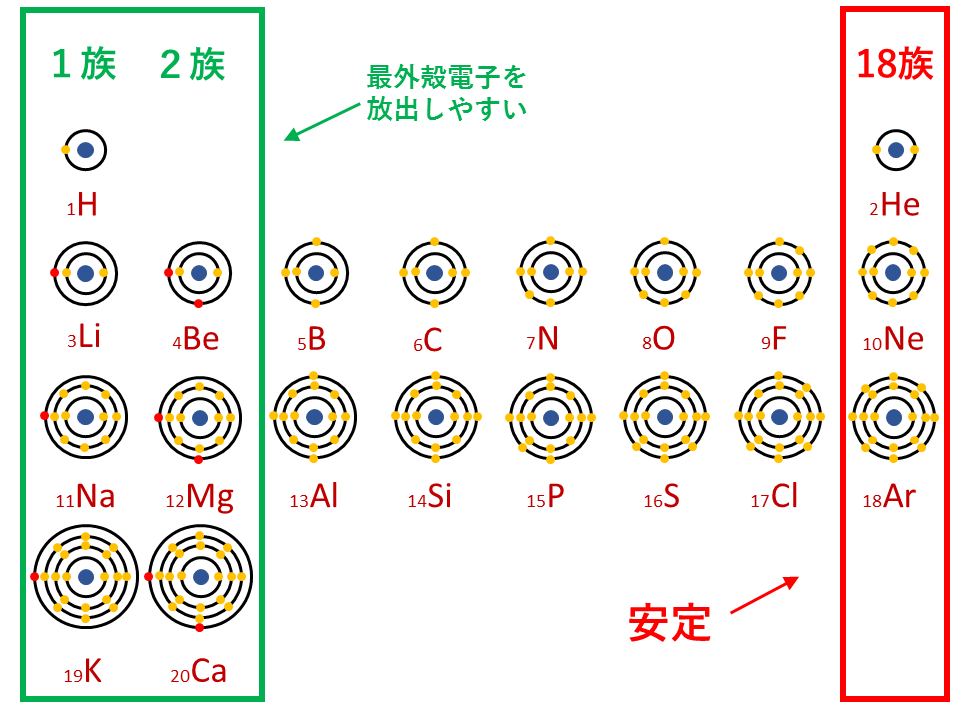
イオン化エネルギーは周期表の右上が最大
それでは、なぜ周期表の右上が最もイオン化エネルギーが大きいのでしょうか。 縦(族)と横(周期)を分けて考えてみましょう。周期表の横(周期)についての考察
例えば、周期表の第2周期(Li~Ne)をもとに説明していきます。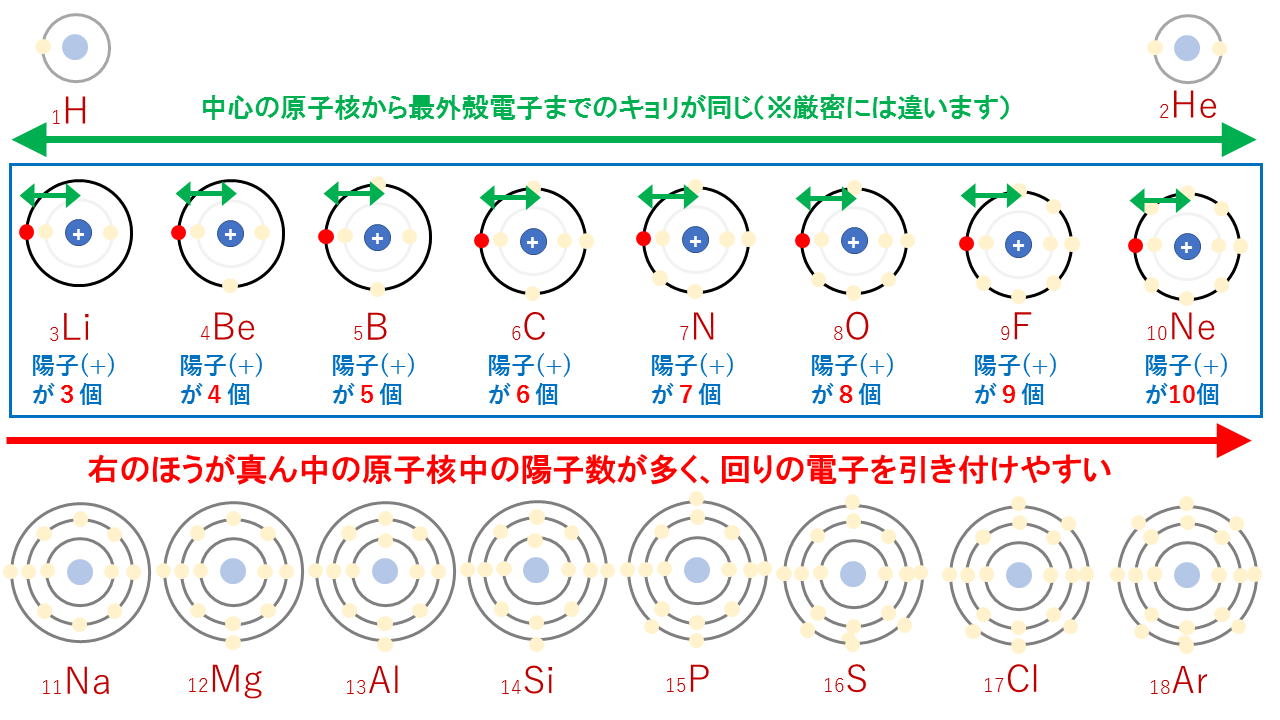 第2周期の最外殻はすべてL殻であり、真ん中にある原子核からの距離がどの原子でも同じです。※本当は違います。詳しくは原子半径(原子の大きさ)と周期表での大小関係とその理由を参照ください。
では何が違うのかというと、真ん中の原子核内にある陽子(+)の個数が違います。
真ん中の原子核内にある陽子(+)が多いほど、回りの電子を引き付けやすいはずです。つまり、周期表の右側の方が原子番号が大きく、陽子数が多いため、電子を引き付ける強さが強くなります。そのため、右側の方が電子を取り去るのに大きなエネルギーが必要となります。
よって、周期表の右側の方がイオン化エネルギーが大きいのです。
第2周期の最外殻はすべてL殻であり、真ん中にある原子核からの距離がどの原子でも同じです。※本当は違います。詳しくは原子半径(原子の大きさ)と周期表での大小関係とその理由を参照ください。
では何が違うのかというと、真ん中の原子核内にある陽子(+)の個数が違います。
真ん中の原子核内にある陽子(+)が多いほど、回りの電子を引き付けやすいはずです。つまり、周期表の右側の方が原子番号が大きく、陽子数が多いため、電子を引き付ける強さが強くなります。そのため、右側の方が電子を取り去るのに大きなエネルギーが必要となります。
よって、周期表の右側の方がイオン化エネルギーが大きいのです。
周期表の縦(族)についての考察
それでは次に、周期表の縦(族)について考察します。 例えば、周期表の第18族(He,Ne,Ar,…)をもとに説明していきます。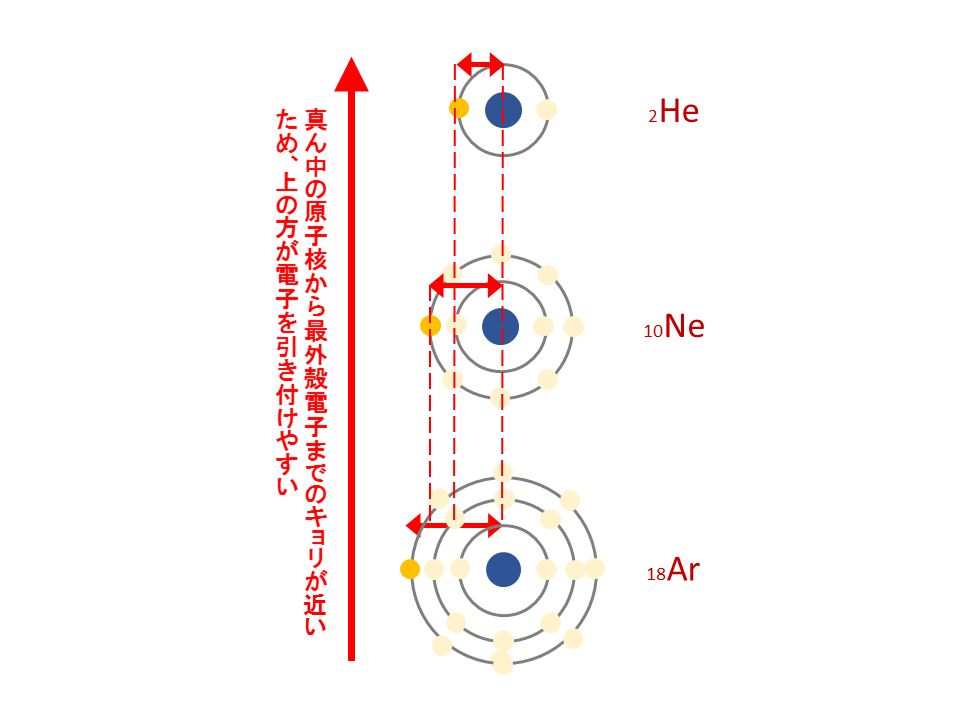 第1周期のHeの最外殻はK殻であり、真ん中にある原子核からの距離が最も近いです。
第2周期のNeの最外殻はL殻であり、真ん中にある原子核からの距離が少し遠ざかります。
第3周期のArの最外殻はM殻であり、真ん中にある原子核からの距離がさらに遠ざかります。
最外殻電子が原子核(+)に近い周期表の上側の方が電子を引き付けやすいはずです。つまり、周期表の上側の方が、最外殻までの距離が近いため、電子を引き付ける強さが強くなります。そのため、上側の方が電子を取り去るのに大きなエネルギーが必要となります。
よって、周期表の上側の方がイオン化エネルギーが大きいのです。
第1周期のHeの最外殻はK殻であり、真ん中にある原子核からの距離が最も近いです。
第2周期のNeの最外殻はL殻であり、真ん中にある原子核からの距離が少し遠ざかります。
第3周期のArの最外殻はM殻であり、真ん中にある原子核からの距離がさらに遠ざかります。
最外殻電子が原子核(+)に近い周期表の上側の方が電子を引き付けやすいはずです。つまり、周期表の上側の方が、最外殻までの距離が近いため、電子を引き付ける強さが強くなります。そのため、上側の方が電子を取り去るのに大きなエネルギーが必要となります。
よって、周期表の上側の方がイオン化エネルギーが大きいのです。
発展
ここでよく言われる疑問です。『確かに周期表の下の方は距離が遠くなるが、その分原子番号が大きいので、陽子数が増え、引きつける力も増すのでは?』
その通りなんです。陽子数が増えることと、距離が遠くなることのどちらの影響が強いかの兼ね合いになります。
ここで物理の公式を紹介します。静電気力に関するクーロンの法則
$$F = k\frac{Qq}{r^2}$$
というものです。
2つの電荷がある際に及ぼし合う引力(または斥力)の大きさに関する公式です。
k は比例定数で、r は2つの電荷の距離、Q とq はそれぞれの電気量(陽子や電子の個数みたいなイメージ)です。
今、電子1個を取り去る話をしているので、電子1個と原子核(陽子複数個)との間の静電気力を比較します。
Q とq のうち、片方は電子1個で共通しているので、
静電気力は原子核の陽子数の1乗に比例し、最外殻電子までの距離の2乗に反比例します。
もちろん2乗の方が影響力が強いです。そのため、周期表の下の方は陽子数が増えるけれど、距離が遠くなることの方が影響力があるため、静電気力(引力)が弱まります。よって、電子の引きつけ度合いが小さくなり、イオン化エネルギーは下の方が小さくなります。
イオン化エネルギーは周期表の右上が最大
 結論としてイオン化エネルギー最大の元素はHeということです。
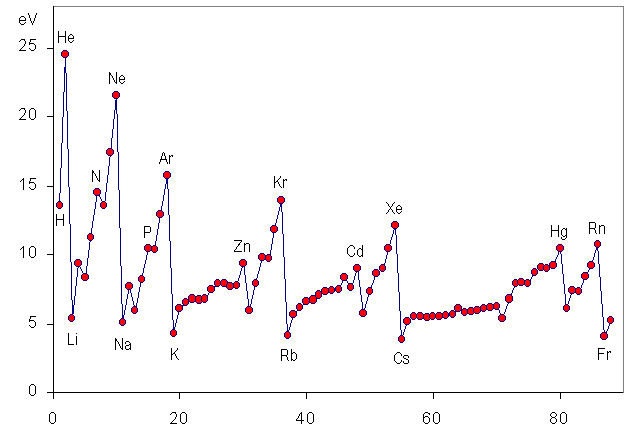
以下がイオン化エネルギーの大きさに関するグラフです。
結論としてイオン化エネルギー最大の元素はHeということです。
以下がイオン化エネルギーの大きさに関するグラフです。
 出典:https://ja.wikipedia.org/wiki/%E3%82%A4%E3%82%AA%E3%83%B3%E5%8C%96%E3%82%A8%E3%83%8D%E3%83%AB%E3%82%AE%E3%83%BC
出典:https://ja.wikipedia.org/wiki/%E3%82%A4%E3%82%AA%E3%83%B3%E5%8C%96%E3%82%A8%E3%83%8D%E3%83%AB%E3%82%AE%E3%83%BC
グラフを御覧頂けばわかりますが、厳密に全て右上の方に位置する元素が大きくなるわけではありません。本来は電子同士の相互作用も影響するため、若干の例外はありますが、大学受験レベルとしてはおおまかに「右上が大きい」と捉えておいて問題ありません。
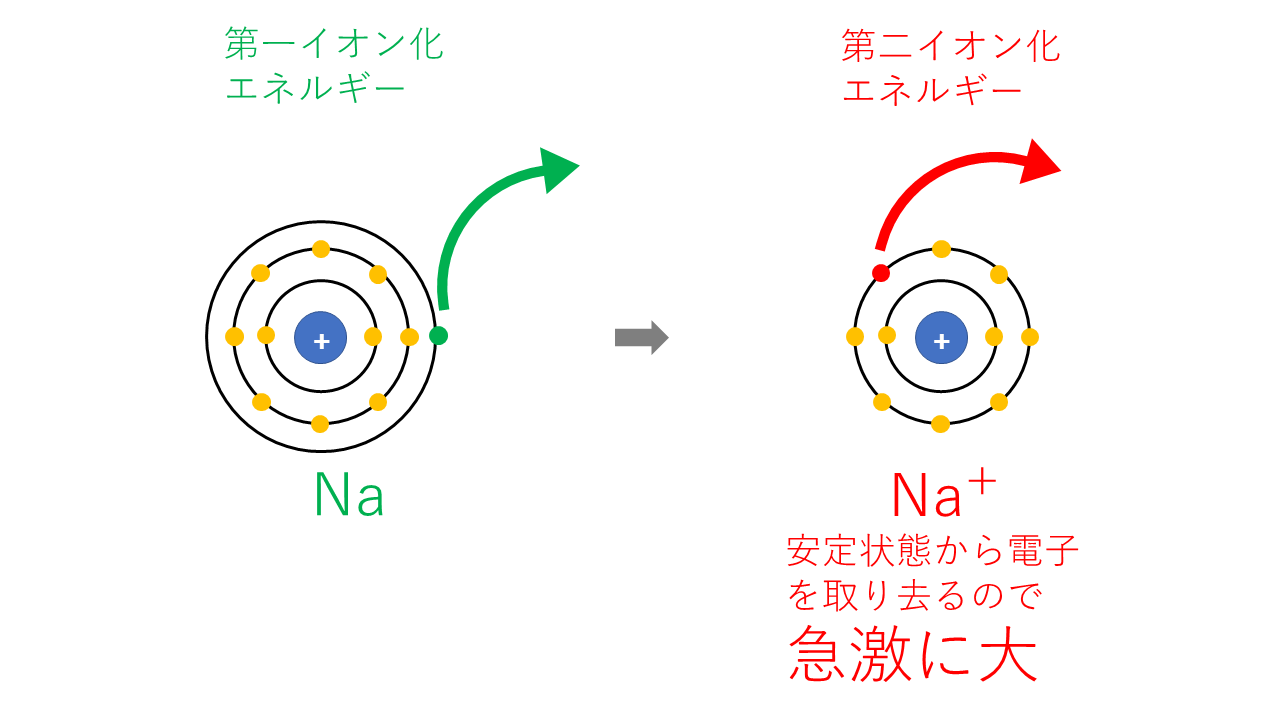
さて、冒頭でも少し触れていますが、これまで説明してきました「イオン化エネルギー」は、実は「第一イオン化エネルギー」といいます。
第nイオン化エネルギーという考え方についてはコチラの記事を参照ください。
第nイオン化エネルギーが急激に大きくなる問題の攻略法