最外殻電子と価電子は基本的には同じ数値をとりますが、希ガスの場合に異なります。最外殻電子と価電子それぞれの定義と違いを具体的かつ丁寧に解説します。
僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
最外殻電子と価電子の概要
まず最初に定義を確認しましょう。
それでは一つ一つ見ていきましょう。
最外殻電子
「最も外側にある電子殻に存在する電子」のことです。
例えば、
原子番号7番のN(窒素)について
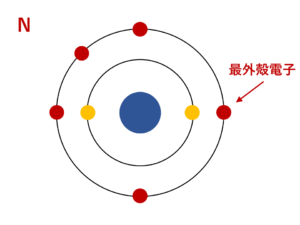
窒素はK殻とL殻をもっていて、最外殻はL殻です。そのため、L殻に存在している5個の電子が最外殻電子ということになります。
次に
原子番号18番のAr(アルゴン)について
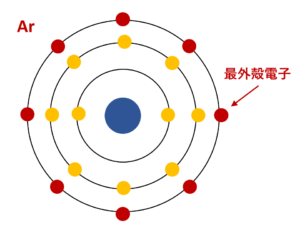
アルゴンはK殻とL殻とM殻をもっていて、最外殻はM殻です。そのため、M殻に存在している8個の電子が最外殻電子ということになります。
価電子
価電子とは、「反応に使われる電子」のことです。
原子の持つ電子の中で他の原子との反応に使われるのは最も外側にある電子なので、ほとんどの場合価電子は最外殻電子と同じです。
ただし、希ガスは閉殻またはオクテットであるため化学的に安定的で、他の原子とは基本的に反応しません。つまり、希ガスは価電子が0となります。
例えば、
原子番号7番のN(窒素)について

窒素はK殻とL殻をもっていて、最外殻はL殻です。そのため、L殻に存在している5個の電子が価電子ということになります。
次に
原子番号18番のAr(アルゴン)について
-300x225.png)
アルゴンはK殻とL殻とM殻をもっていて、最外殻はM殻です。しかし、最外殻電子は8個でありオクテットで他の原子とは反応しないため、0個となります。
最外殻電子と価電子の違い
基本的には同じですが、希ガスのみ違います。
例えば、希ガスの一つであるアルゴンArは、最外殻電子を「8コ」持っていますが、オクテットであるため化学的に安定的であり、それら8コの最外殻電子が反応に使われることはほぼありません。
そのため、アルゴンArの最外殻であるM殻の8コの電子は、最外殻電子ではあるが価電子ではない。
| 原子 | 原子番号 | 電子殻 | |||
| K | L | M | N | ||
| He | 2 | ② | |||
| Ne | 10 | 2 | ⑧ | ||
| Ar | 18 | 2 | 8 | ⑧ | |
| Kr | 36 | 2 | 8 | 18 | ⑧ |
He ⇒ 最外殻電子:2個 価電子:0個
Ne ⇒ 最外殻電子:8個 価電子:0個
Ar ⇒ 最外殻電子:8個 価電子:0個
Kr ⇒ 最外殻電子:8個 価電子:0個
さいごに
最外殻電子と価電子の違いはわかりましたか?結局のところ、希ガス以外は同じで、価電子は希ガスでは0とカウントし、最外殻電子は見た目通りの個数を数えるということです。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。

.png)