【語呂合わせ・練習問題付き】倍数比例の法則・定比例の法則・気体反応の法則・質量保存の法則・アボガドロの法則のそれぞれの定義と違いについて解説しています。また、発見者とセットの覚え方(語呂合わせ)と入試問題例(練習問題)でこの単元をマスターしましょう。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
倍数比例の法則とは
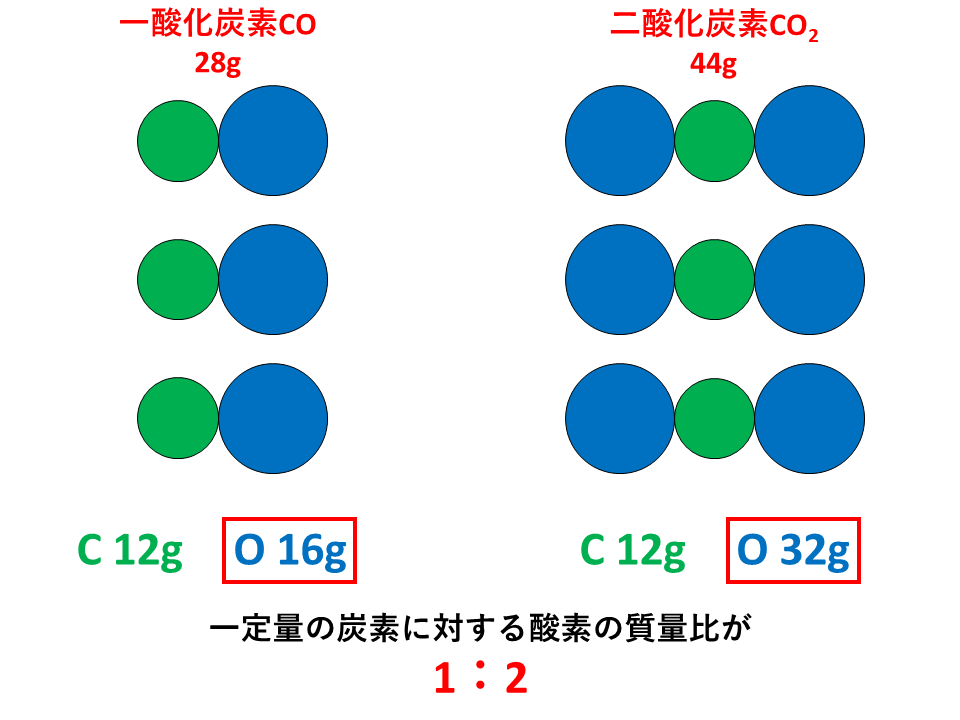
倍数比例の法則とは、「2種類の元素AとBが化合して,いくつかの異なる化合物を作るとき,一定質量のAとBの質量の間には,簡単な整数比が成り立つ。」というものです。
倍数比例の法則の発見者はドルトンであり、発見した年は1803年です。
気体反応の法則とは
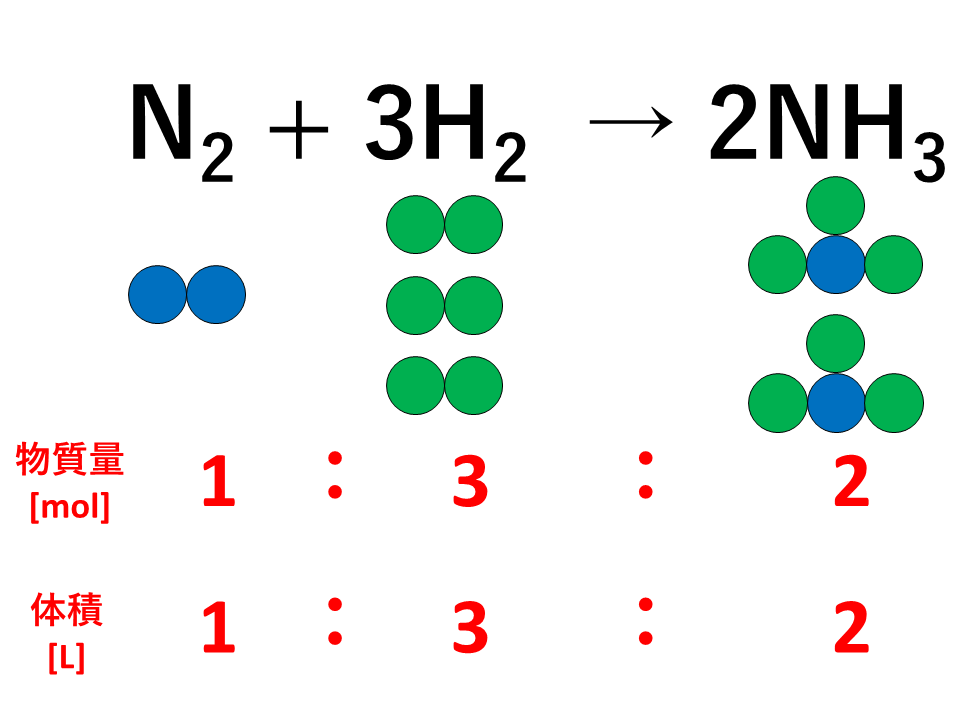
気体反応の法則とは、「気体どうしの反応では,反応に関する気体の体積の間には,同温・同圧のもとでは,簡単な整数比が成り立つ。」というものです。
気体反応の法則の発見者はゲーリュサックであり、発見した年は1808年です。
定比例の法則とは

定比例の法則とは、「ある化合物を構成する成分元素の質量比は,その製法の如何を問わず,常に一定である。」というものです。
定比例の法則の発見者はジョゼフ・ルイ・プルーストであり、発見した年は1799年です。
質量保存の法則とは

質量保存の法則とは、「化学反応の前後において,物質の総質量は変化しない。」というものです。
質量保存の法則の発見者はラボアジエであり、発見した年は1774年です。
アボガドロの法則とは

アボガドロの法則とは「同一圧力・同一温度下では、全ての気体は同一体積に同じ数の分子が含まれる」というものです。
アボガドロの法則の発見者はアボガドロであり、発見した年は1811年です。
倍数比例・定比例・気体反応・質量保存の法則の覚え方(語呂合わせ)
法則名と内容、発見者の組み合わせを答えさせる問題が入試で出題されます。
法則名と内容の組み合わせは上記で理解しながら覚えてください。
発見者は丸暗記するしかありません。
そのための有名な語呂合わせを紹介します。(アボガドロの法則は発見者の名前がついているので大丈夫ですね。)
ドバイ劇のテープ知らない?
| ド | バイ | げ | きの | テー | プ | 知 | らない? |
| ドルトン | 倍数比例の法則 | ゲーリュサック | 気体反応の法則 | 定比例の法則 | プルースト | 質量保存の法則 | ラボアジエ |
化学の基礎法則に関する入試問題例(2000年 昭和薬科大)
A 欄の記述に関係ある法則と人名を B 欄, C 欄からそれぞれ 1 つずつ選び記号で答えよ。なお,選択項目は何度選択してもよい。
[A欄](1) 2.000g の水素と 15.873gの酸素から17.873gの水ができる。
(2) 酸化銅(Ⅱ) 中の銅と酸素の質量比は常に 1:0.252である。
(3) 水素の2.000gと化合する酸素の質量は水では15.873g,過酸化水素では31.746gとなる。
(4) 水素と酸素が反応して水蒸気が生成するとき,反応に関与したそれらの体積比は,同温,同圧で2:1:2である。 [B欄]
(a) アボガドロの法則 (b) 気体反応の法則
(c) 質量作用の法則 (d) 質量保存の法則
(e) 総熱量保存の法則 (f) 定比例の法則
(g) 倍数比例の法則 (h) 分圧の法則 [C欄]
( ア ) ボイル ( イ ) シュタール ( ウ ) ラボアジエ
( エ ) プルースト ( オ ) ドルトン ( カ ) ヘンリー
( キ ) ゲーリュサック ( ク ) アボガドロ ( ケ ) ヘス
( コ ) グルベル [su_spoiler title=”【解答解説】※タップで表示” style=”fancy”]
【解答】(1) d ,ウ (2) f ,エ (3) g ,オ (4) b ,キ
【解説】
(1) 反応物(2.000g + 15.873g)と生成物(17.873g)の質量の総和が等しいという関係を述べているので質量保存の法則(ラボアジエ)となります。
(2) CuOを構成するCu:O = 1:0.252≒4:1(質量比)であり、1種類の化合物内の元素の比率に関する記述なので定比例の法則(プルースト)となります。
(3) 水と過酸化水素では,一定質量の水素と化合する酸素の質量比は,15.873:31.746 = 1:2 のように簡単な整数比になるという、2種類の化合物内の元素に倍数の関係が成り立つことを示した記述なので倍数比例の法則(ドルトン)となります。
(4) 2H2 + O2 → 2H2Oのように気体が反応する際、係数比2:1:2 = モル比2:1:2 = 体積比2:1:2となることを示した記述なので気体反応の法則(ゲーリュサック)となります。
さいごに
本記事の練習問題のような選択問題は苦手とする生徒が多いです。
なぜなら出題頻度がそこまで高いため、盲点となりがちだからです。そのうえ、語呂合わせを知らない人も多く、覚えていない生徒も多数います。なので、ここをしっかり覚えておくのは差をつけるチャンスととらえることも可能ですので、お気に入りに保存して繰り返し復習するなど、しっかりと覚えておきましょう。
なお、復習はタイミングが命なので、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法で書いている復習のタイミングも参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。