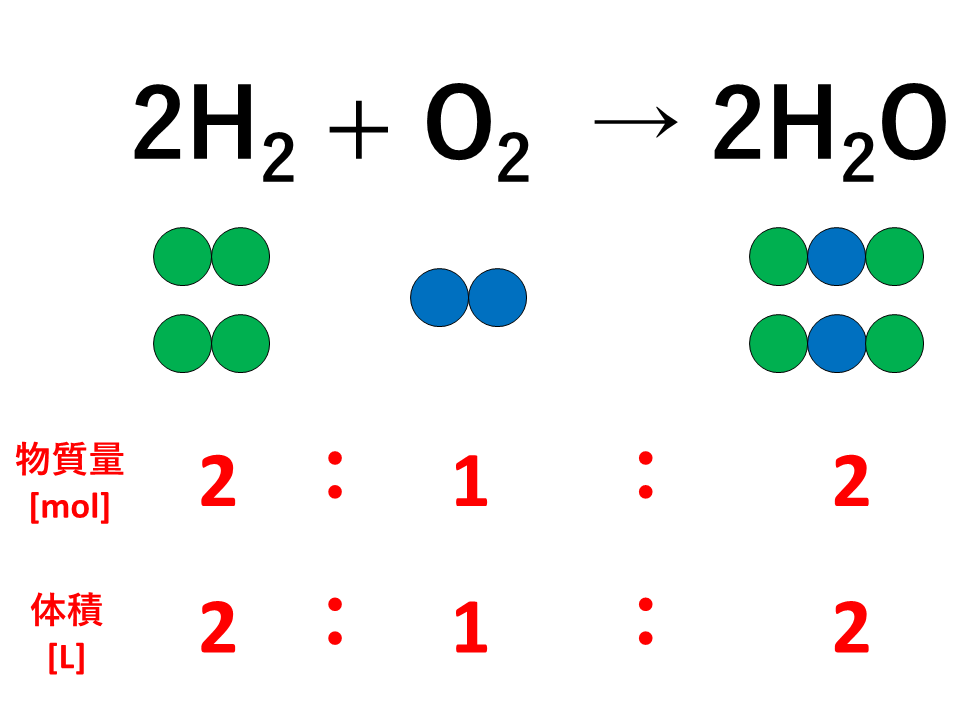質量保存の法則とは、「化学反応の前後において,物質の総質量は変化しない。」というものです。本記事では、質量保存の法則を具体例を踏まえてわかりやすく解説します。発見者ラボアジエもセットで覚えましょう。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
質量保存の法則とは
質量保存の法則とは、「化学反応の前後において,物質の総質量は変化しない。」というものです。
【例1】
例えば、炭素と酸素から二酸化炭素が生成する場合について考えてみます。
C + O2 → CO2
12g 32g 44g
この反応において、炭素12gと酸素32gを反応させると、二酸化炭素が44g生成します。
反応前は炭素12gと酸素32gで全体の質量は44g、反応後は二酸化炭素が44gあるので全体の質量は44gであり、反応の前後で全体の質量が変わっていないことがわかります。
【例2】
例えば、エタンと酸素から二酸化炭素と水が生成する場合について考えてみます。
2C2H6 + 7O2 → 4CO2 + 6H2O
60g 224g 176g 108g
この反応において、エタン60gと酸素224gを反応させると、二酸化炭素176gと水108gが生成します。
反応前はエタン60gと酸素224gで全体の質量は284g、反応後は二酸化炭素176gと水108gで全体の質量は284gであり、反応の前後で全体の質量が変わっていないことがわかります。
質量保存の法則の発見者ラボアジエ

質量保存の法則の発見者はラボアジエであり、発見した年は1774年です。
組合せが出題されるので覚えておきましょう。覚え方は以下から。
さいごに
質量保存の法則は内容自体はなじみのあるわかりやすいものですが、発見者はなかなか覚えていない人も多いと思いますので、まだ覚えられていない人は、【完全版】倍数比例の法則・定比例の法則・気体反応の法則・質量保存の法則・アボガドロの法則の覚え方(語呂合わせ/練習問題付)で紹介している語呂合わせで覚えてみてください。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。