モル濃度とは、溶質のモル(mol)/溶液の体積(L)で表される、入試必出の知識です。本記事では、溶液、溶媒、溶質の違い、モル濃度と密度、質量パーセント濃度の違い、公式、求め方、関係性について、図と入試頻出の練習問題でわかりやすく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
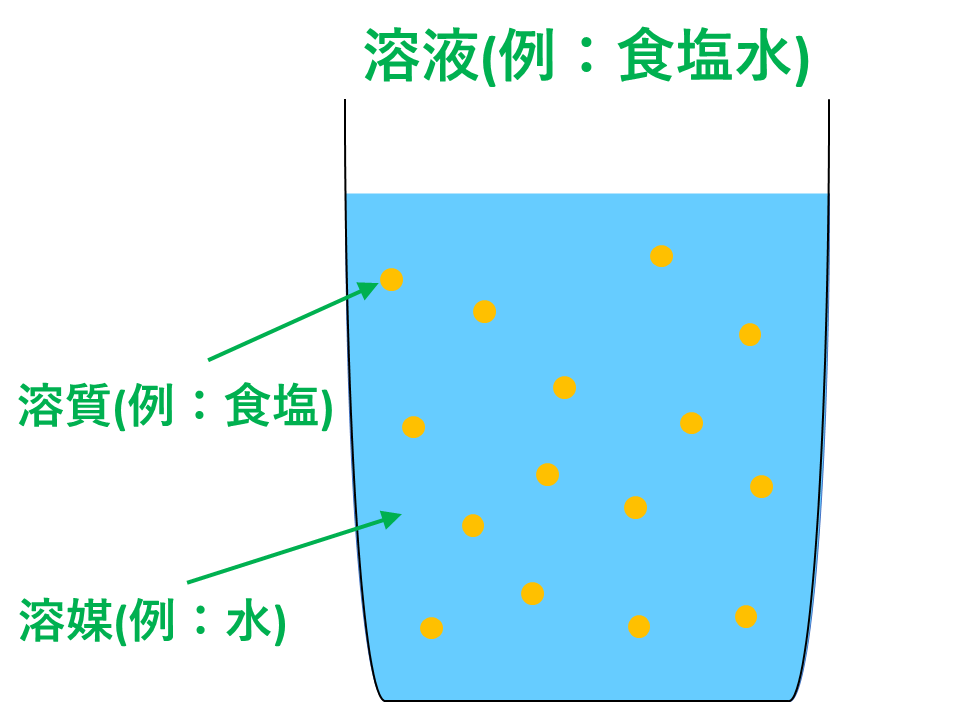
溶解・溶質・溶媒・溶液とは
溶解とは、液体中に他の物質が拡散して均一な液体となる現象です。
溶質とは、溶け込んだ物質であり、溶媒とはその溶質を溶かす液体であり、溶液とは溶解によって生じた均一な液体混合物です。
例えば、食塩水を例にとると、食塩が溶質、水が溶媒、食塩水自体が溶液ということです。
ちなみに、溶質は固体しかないと思われがちですが,じつは固体、液体、気体いずれの状態もあり得ます。
液体の溶質だと、例えばエタノールです。エタノール(液体)を水に溶かしてエタノール水溶液ができます。

気体の溶質だと、例えば炭酸水です。二酸化炭素(気体)を水に溶かして炭酸水溶液ができます。

モル濃度とは
モル濃度とは、溶質の物質量[mol]を溶液の体積[L]で割ったものです。
モルとは個数のことでした。(1mol = 6.0×1023個)
公式です。
$$モル濃度[mоl/L] = \frac{溶質の物質量[mоl]}{溶液の体積[L]}$$
$$溶質の物質量[mоl] = モル濃度[mоl/L]×溶液の体積[L]$$
【例題1】 NaOH = 40のとき、NaOH2.0gを水に溶かして全体で2.0Lとしたときのモル濃度を求めよ。
[su_spoiler title=”【解答解説1】※タップで表示” style=”fancy”]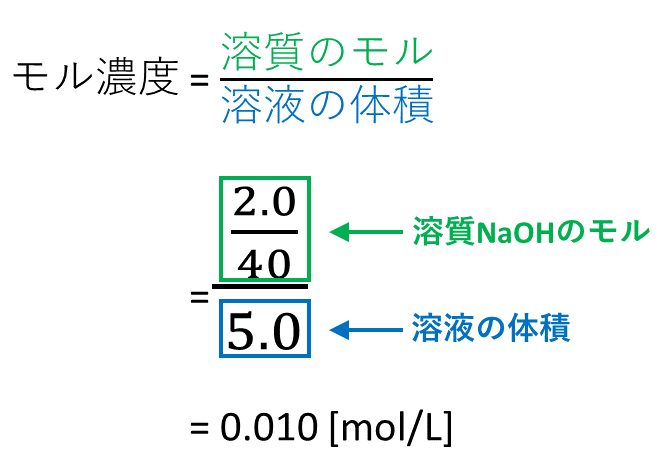
【例題2】0.05mol/Lの水酸化カリウム水溶液が20mLある。この溶液中に含まれる水酸化カリウムは何molか。
[su_spoiler title=”【解答解説2】※タップで表示” style=”fancy”]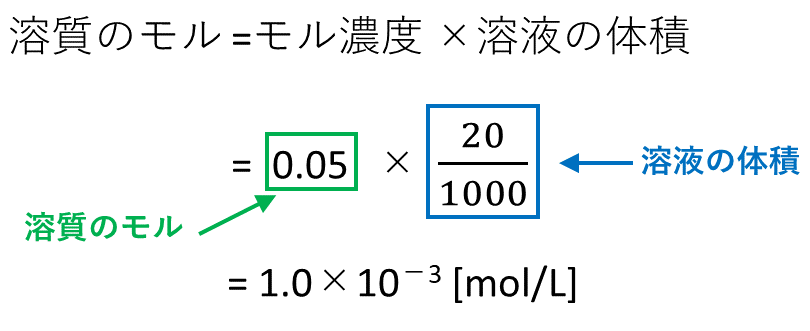
質量パーセント濃度とは
質量パーセント濃度とは、溶質の質量[g]を溶液全体の質量[g]で割って100をかけたものです。
以下公式です。
$$質量パーセント濃度[%] = \frac{溶質の質量[g]}{溶液の質量[g]}×100$$
溶液の質量がわかっていて溶質の質量が求めたいときや、逆に溶質の質量はわかっていて溶液の質量が求めたいときに使います。
密度とは
密度とは、溶液全体の質量[g]を溶液全体の体積[L]で割ったものです。
以下公式です。
$$密度[g/cm^3] = \frac{溶液全体の質量[g]}{溶液全体の体積[cm^3]}$$
溶液全体の体積がわかっていて溶液全体の質量が知りたいときや、溶液全体の質量がわかっていて溶液全体の体積が知りたいときに使います。
質量モル濃度とは
おまけです。質量モル濃度とは、溶質の物質量[mol]を溶媒の質量[kg]で割ったものです。
公式です。
$$質量モル濃度[mоl/kg] = \frac{溶質の物質量[mоl]}{溶媒の質量[kg]}$$
モル濃度との違いは分母です。
モル濃度では、溶液の体積[L]だったのに対し、質量モル濃度では溶媒の質量[kg]です。
気を付けましょう。化学でkg単位を使うのは唯一この質量モル濃度だけです。
なぜkg単位を使うかというと、モル濃度と質量モル濃度であまりに大きな数値の乖離がないように調整するためです。
具体的に考えてください。例えば砂糖1molを水1kg(=1L)に溶かします。
このときモル濃度は約1mol/Lです。(砂糖が水に溶けたら厳密には1Lではなくなる)
それに対し質量モル濃度は1mol/kgです。
もしも質量モル濃度がg単位だったとしたら、0.001[mol/g]となり、1000倍も乖離が生まれてしまい、不適当だからです。
頻出の練習問題
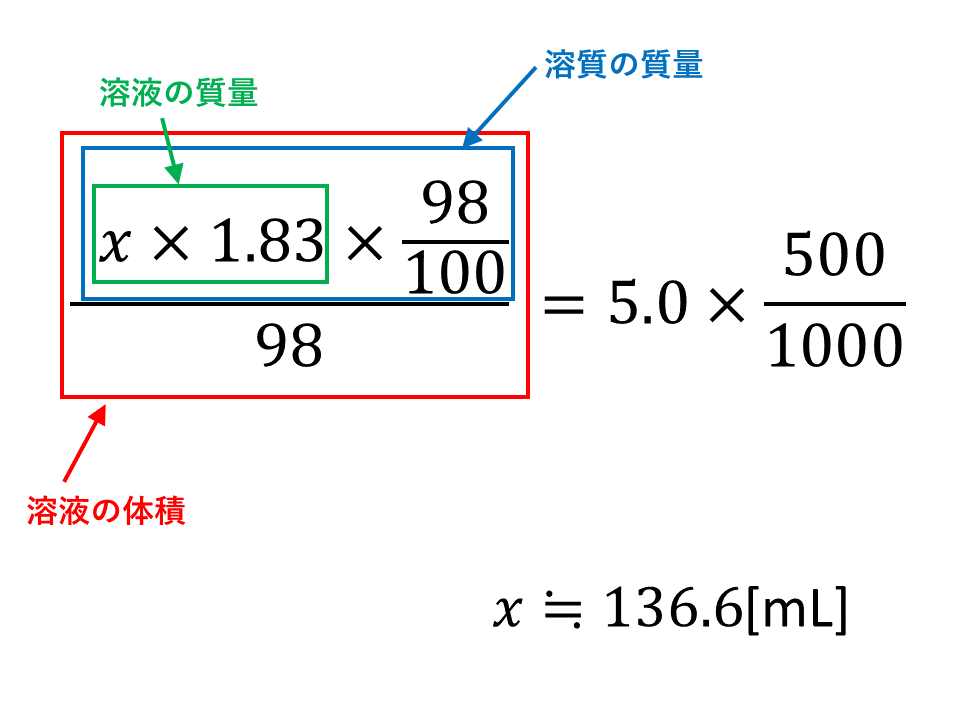
質量パーセント濃度が98%の濃硫酸があり、その密度は25℃で1.83g/cm3である。この濃硫酸を水で薄めて、5.0mol/Lの希硫酸500mLをつくるには、何mLの濃硫酸が必要か。
[su_spoiler title=”【解答解説】※タップで表示” style=”fancy”]【解答】714g
【解説】そもそも濃硫酸と希硫酸は溶質=硫酸、溶媒=水という点は同じです。違いは文字通り濃いか薄いかです。
濃硫酸から希硫酸を作る際に、水のみを加えるので、溶質である硫酸のモルは変わりません。この点に注目して方程式を立てる必要があります。つまり、濃硫酸側から導いた溶質(硫酸分子)のモルと希硫酸側から導いた溶質(硫酸分子)のモルが等しいという式を立てるのです。
まず、必要な濃硫酸をx[mL]とおきます。
濃硫酸側
溶質(硫酸分子)のモルを表したいです。
流れとしては、溶液の体積【x [mL]】⇒密度で溶液の質量に変換【x×1.83[g]】⇒質量パーセント濃度で溶質(硫酸分子)の質量に変換【x×1.83×(98/100)⇒硫酸の分子量で割ってモルに変換 という流れになります。
希硫酸側
溶質(硫酸分子)のモルを表したいです。モル濃度×体積で表すことができます。
さいごに
本記事で解説した「質量モル濃度」は若干出題頻度としては低めですが、モル濃度は超超超頻出なので、絶対にマスターしておいてください。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。