電離度とは電離する(イオンに分かれる)割合のことです。本記事では、電離度の意味と、酸・塩基の強弱にどのような関係性があるのかを解説し、強酸・強塩基の性質や弱酸・弱塩基の性質の違いについてわかりやすく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
酸・塩基の強弱
水溶液中のH+の濃度が大きいほど酸性は強く,OH-の濃度が大きいほど(H+の濃度が小さいほど)塩基性は強くなります。
一見、価数が酸塩基の強弱に影響しそうですが、価数よりも圧倒的に電離度のほうが影響します。
では電離度とは何でしょうか。
電離度
電離度とは、溶液中で溶質が電離する割合のことです。
酸・塩基は電解質であり、溶液中で電離してH+,OH-を生じます。しかし,すべてが電離するわけではありません。そこで、
$$電離度α = \frac{電離している酸・塩基の物質量[mоl]}{溶解している酸・塩基の物質量[mоl]} (0 < α ≦1) $$
と定義します。
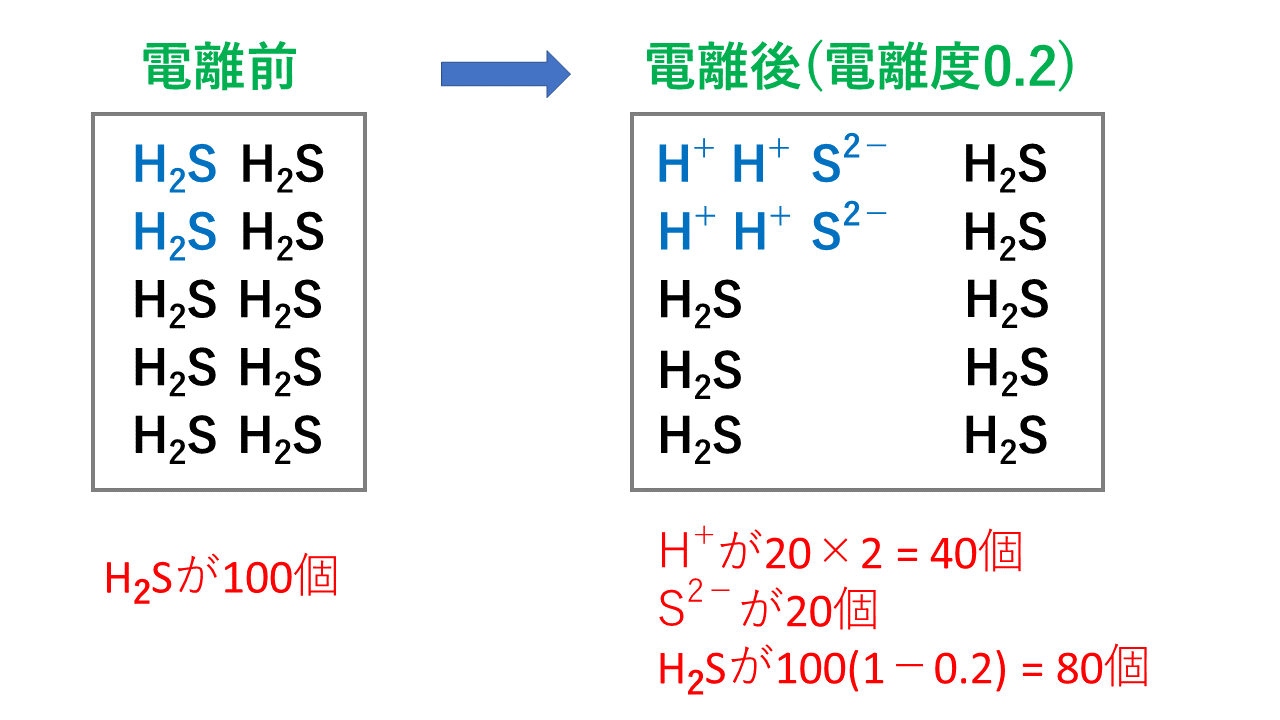
![電離の様子]() 例えば、硫化水素 H2Sの電離度が0.2で、100個あったとすると、
H2S100個のうち、0.2の割合で電離(イオンに分かれる)します。
つまり、20個電離します。(実際は多段階電離なので違いますが、サンプルとして理解してください)
電離度0.2ということは、電離しない割合は1-0.2 = 0.8なので、80個(100×0.8)が電離せず H2Sのまま残ります。
そして、電離後は、 H2S ⇄ 2H+ + S2- となるため、
H+は20×2 = 40個、S2-は20個となります。
これをモル濃度(溶液1Lあたりの溶質のモル)で考えるのが基本です。
一般的に以下のように考えます。
Cmol/lの酢酸があり,その電離度をαとする。
反応式 CH3COOH ⇄ CH3COO- + H+
電離前 Cmol/L 0 0
電離後 C(1-α) mol/L Cα mol/L Cα mol/L
例えば、硫化水素 H2Sの電離度が0.2で、100個あったとすると、
H2S100個のうち、0.2の割合で電離(イオンに分かれる)します。
つまり、20個電離します。(実際は多段階電離なので違いますが、サンプルとして理解してください)
電離度0.2ということは、電離しない割合は1-0.2 = 0.8なので、80個(100×0.8)が電離せず H2Sのまま残ります。
そして、電離後は、 H2S ⇄ 2H+ + S2- となるため、
H+は20×2 = 40個、S2-は20個となります。
これをモル濃度(溶液1Lあたりの溶質のモル)で考えるのが基本です。
一般的に以下のように考えます。
Cmol/lの酢酸があり,その電離度をαとする。
反応式 CH3COOH ⇄ CH3COO- + H+
電離前 Cmol/L 0 0
電離後 C(1-α) mol/L Cα mol/L Cα mol/L
強酸・強塩基
ほぼ全てが電離する、つまり電離度α≒1の酸・塩基のことを強酸・強塩基といいます。
強酸や強塩基は完全電離するため、反応式では「→」を使って表します。これは、右向きしか起こらない反応ということを表します。
HCl → H+ + Cl-
左の分子HClのような結合状態が不安定で、右のイオンの状態Cl-が安定的なので電離してH+ を大量に放出できるため、強酸である、ということです。
大切なのは、強酸、強塩基はイオンの状態が安定で結合状態が不安定というイメージを持つことです。
高校化学で覚えるべき強酸・強塩基
| 強酸 |
硫酸(H2SO4),硝酸(HNO3),
塩酸(HCl),臭化水素酸(HBr),ヨウ化水素酸(HI) |
| 強塩基 |
水酸化ナトリウム(NaOH),水酸化カリウム(KOH),水酸化カルシウム(Ca(OH)2),水酸化バリウム(Ba(OH)2) |
強酸・強塩基を必ず覚え、それ以外は弱酸・弱塩基と覚えましょう。
強酸は、硫酸と硝酸とハロゲンのフッ化水素酸以外と覚えます。
強塩基は、アルカリ金属、アルカリ土類金属の水酸化物のみと覚えましょう。
弱酸・弱塩基
電離度が1に比べて十分小さい、一部しか電離しない酸・塩基のことを弱酸・弱塩基といいます。
弱酸や弱塩基は、電離度が小さく、イオンに別れにくく、例えイオンになっても再びくっつきやすいということです。そのため、イオン同士がくっつく方法の反応、つまり左向きの反応もあり得るため、「⇄」を使って表されます。
CH3COOH ⇄ CH3COO- + H+
左の分子CH3COOHのような結合状態が安定的で、右のイオンの状態 CH3COO-が不安定なのでほとんど電離せずH+ をほとんど放出しないため、弱酸である、ということです。
大切なのは、弱酸、弱塩基は結合状態が安定でイオンの状態が不安定というイメージを持つことです。
高校化学で頻出の弱酸・弱塩基
| 弱酸 |
酢酸(CH3COOH)、フッ化水素(HF)、
炭酸(H2CO3)、硫化水素(H2S)、シュウ酸(H2C2O4または(COOH)2)、
リン酸(H3PO4) |
| 弱塩基 |
アンモニア(NH3)、
水酸化銅(Ⅱ)(Cu(OH)2)、水酸化マグネシウム(Mg(OH)2)、水酸化亜鉛(Zn(OH)2)、水酸化鉄(Ⅱ)(Fe(OH)2)、
水酸化アルミニウム(Al(OH)3)、水酸化鉄(Ⅲ)(Fe(OH)3) |
酸塩基の価数については、以下を参照してください。
さいごに
電離度の理解はできましたか?くりかえし復習して自分で説明できるレベルまで習熟しましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。
 例えば、硫化水素 H2Sの電離度が0.2で、100個あったとすると、
H2S100個のうち、0.2の割合で電離(イオンに分かれる)します。
つまり、20個電離します。(実際は多段階電離なので違いますが、サンプルとして理解してください)
電離度0.2ということは、電離しない割合は1-0.2 = 0.8なので、80個(100×0.8)が電離せず H2Sのまま残ります。
そして、電離後は、 H2S ⇄ 2H+ + S2- となるため、
H+は20×2 = 40個、S2-は20個となります。
これをモル濃度(溶液1Lあたりの溶質のモル)で考えるのが基本です。
一般的に以下のように考えます。
Cmol/lの酢酸があり,その電離度をαとする。
反応式 CH3COOH ⇄ CH3COO- + H+
電離前 Cmol/L 0 0
電離後 C(1-α) mol/L Cα mol/L Cα mol/L
例えば、硫化水素 H2Sの電離度が0.2で、100個あったとすると、
H2S100個のうち、0.2の割合で電離(イオンに分かれる)します。
つまり、20個電離します。(実際は多段階電離なので違いますが、サンプルとして理解してください)
電離度0.2ということは、電離しない割合は1-0.2 = 0.8なので、80個(100×0.8)が電離せず H2Sのまま残ります。
そして、電離後は、 H2S ⇄ 2H+ + S2- となるため、
H+は20×2 = 40個、S2-は20個となります。
これをモル濃度(溶液1Lあたりの溶質のモル)で考えるのが基本です。
一般的に以下のように考えます。
Cmol/lの酢酸があり,その電離度をαとする。
反応式 CH3COOH ⇄ CH3COO- + H+
電離前 Cmol/L 0 0
電離後 C(1-α) mol/L Cα mol/L Cα mol/L