おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
水素結合とは
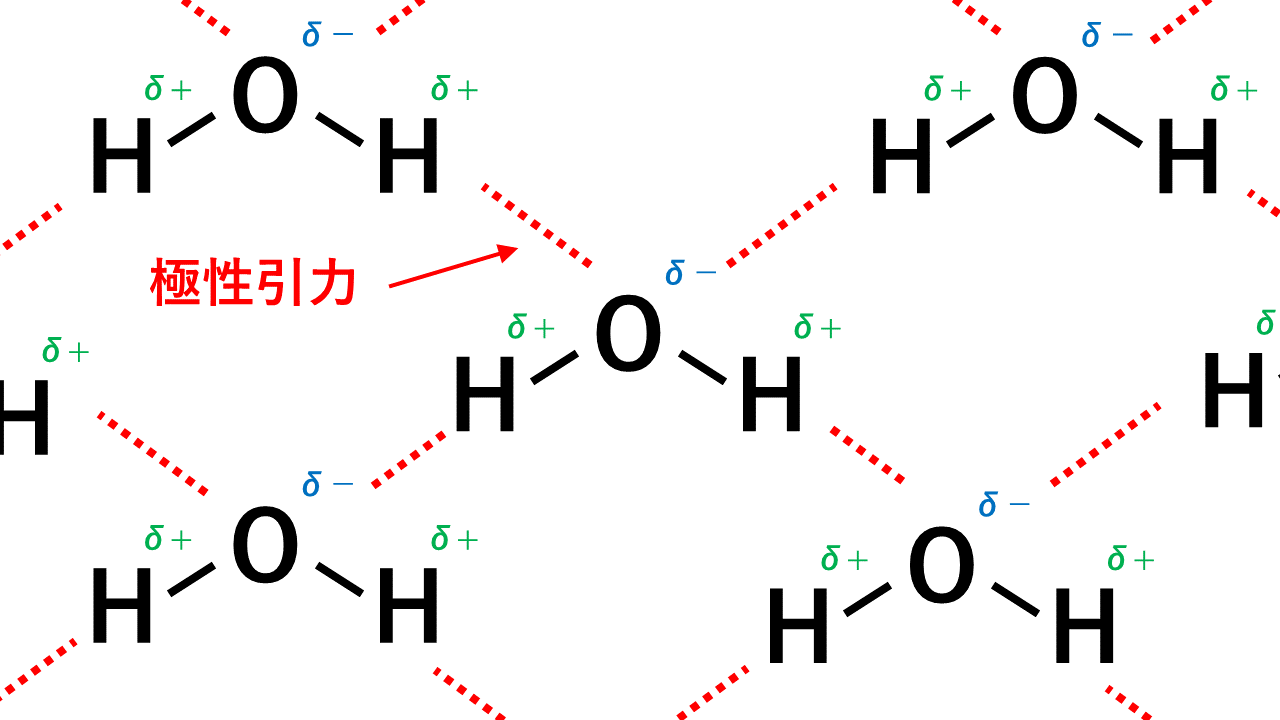
極性分子の中で電気陰性度の差が激しいと極性引力は強くなります。●極性についての詳細は 極性分子と無極性分子の考え方:分子の形と具体例(一覧)
●分子間力の詳細は 分子間力(ファンデルワールス力・極性引力・水素結合)の解説
を参照してください。
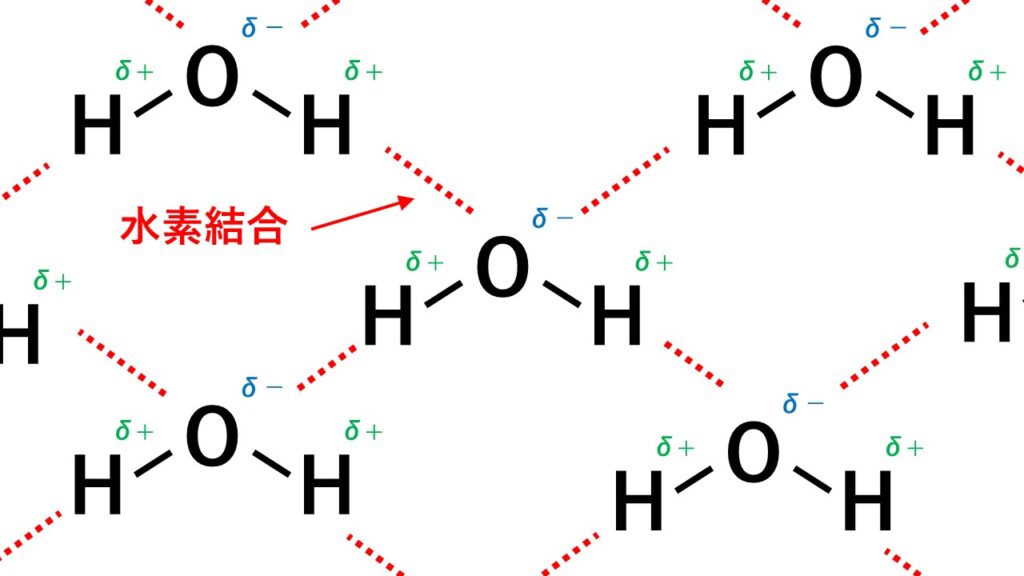
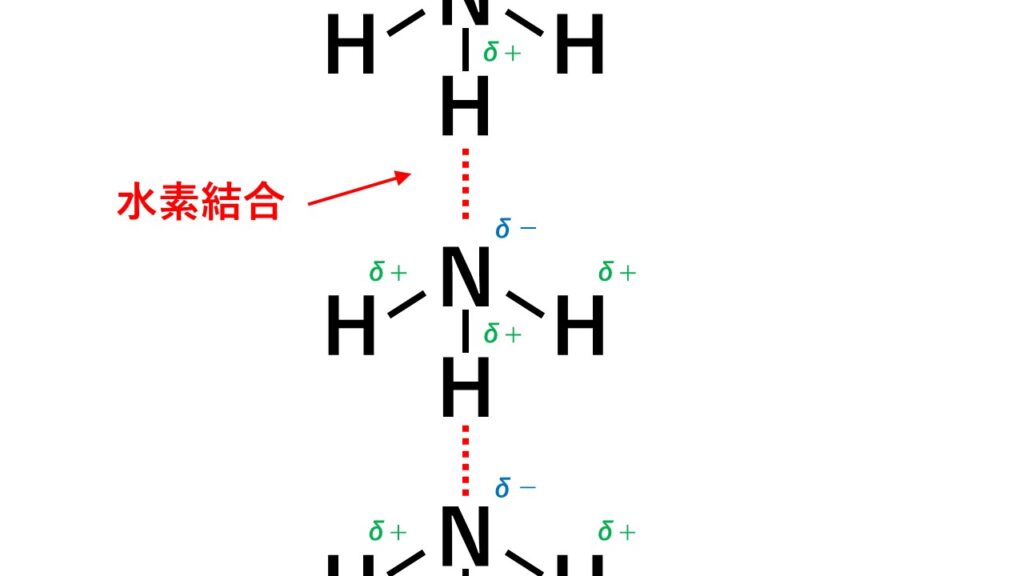
特に電気陰性度が非常に大きいF,O,N原子とH原子の場合にはたらく極性引力を水素結合といいます。
具体的にはHF(フッ化水素)、H2O(水)、NH3(アンモニア)の3種類を覚えておきましょう。※もちろん他にもエタノールC2H5OHなどたくさんあります。
これらの場合、電気陰性度の大きいF,O,N側に共有電子対が引き寄せられマイナスに帯電し、H側はプラスに帯電します。その結果、隣り合う分子同士で水素結合が生じます。
フッ化水素の水素結合の様子
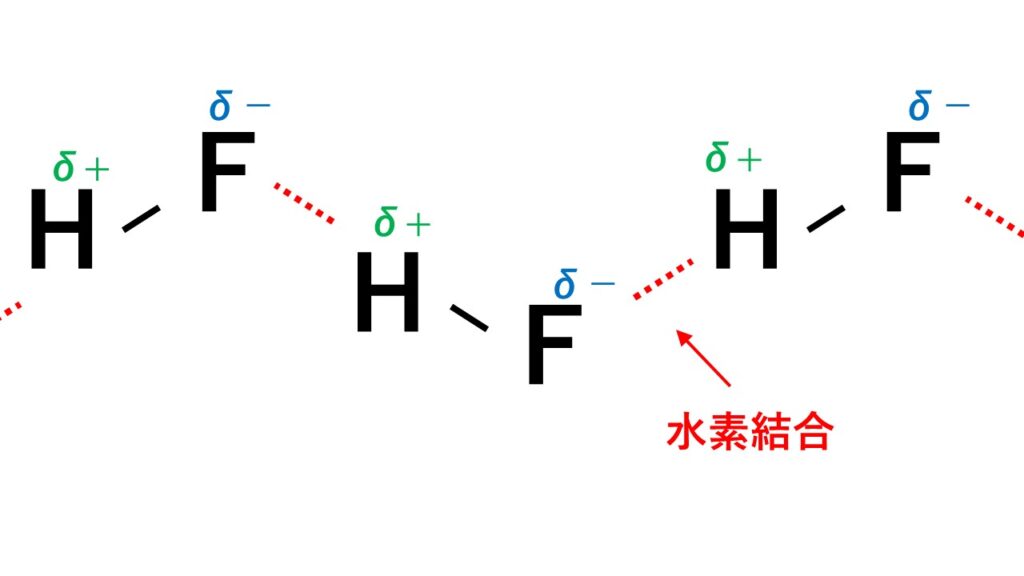
水の水素結合の様子
アンモニアの水素結合の様子
水素結合の強さ
水素結合の強さは、化学結合(共有結合,イオン結合,金属結合)に比べるとずっと弱いですが、ファンデルワールス力よりは強いです。そのため、水素結合を形成している物質は、水素結合を形成しない同程度の分子量をもつ分子性物質に比べて融点や沸点などが異常に高くなります。水素結合と物質の沸点
通常、同族元素の水素化合物は分子量が大きくなるほどファンデルワールス力が強くなるため、沸点が高くなります。しかし、フッ化水素HF,水H2O,アンモニアNH3は分子量が小さいのに大きな沸点を示します。それは、ファンデルワールス力以外に水素結合が働くからです。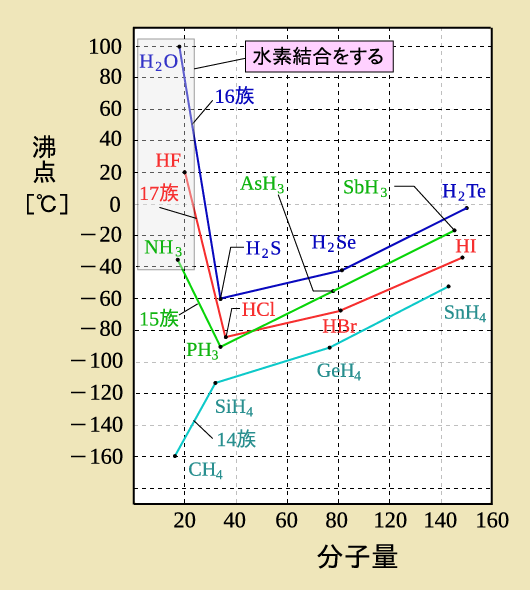 出典:https://commons.wikimedia.org/wiki/File:%E6%B0%B4%E7%B4%A0%E7%B5%90%E5%90%88_%E3%82%B0%E3%83%A9%E3%83%95.svg
それでは、分子量がほとんど変わらないフッ化水素HF,水H2O,アンモニアNH3の沸点を比較してみます。
結論はグラフからわかるとおり、水H2O > フッ化水素HF > アンモニアNH3です。
このようになる理由を考えてみましょう。
出典:https://commons.wikimedia.org/wiki/File:%E6%B0%B4%E7%B4%A0%E7%B5%90%E5%90%88_%E3%82%B0%E3%83%A9%E3%83%95.svg
それでは、分子量がほとんど変わらないフッ化水素HF,水H2O,アンモニアNH3の沸点を比較してみます。
結論はグラフからわかるとおり、水H2O > フッ化水素HF > アンモニアNH3です。
このようになる理由を考えてみましょう。
水素結合自体の強さ
電気陰性度は F > O > N です。このため、水素Hとの電気陰性度の差はフッ化水素HF > 水H2O > アンモニアNH3となります。 よって水素結合自体の強さは、フッ化水素HF > 水H2O > アンモニアNH3となります。1分子から出てくる水素結合の本数
水素結合はH原子と隣の分子の非共有電子対との間で生じます。 上の図からもわかる通り、フッ化水素は1分子あたり2本生じ、水は1分子あたり4本、アンモニアは1分子あたり2本生じます。 この理由は、水素を鍵に、非共有電子対を鍵穴に例えると理解しやすいです。水素結合はいわゆる“鍵”と“鍵穴”が結合した状態と考えられます。 すると、水素結合の本数は鍵の数と鍵穴の数によって決まります。フッ化水素の水素結合の本数
フッ化水素は1分子あたり鍵(H)が1つで鍵穴(非共有電子対)が3つある状態です。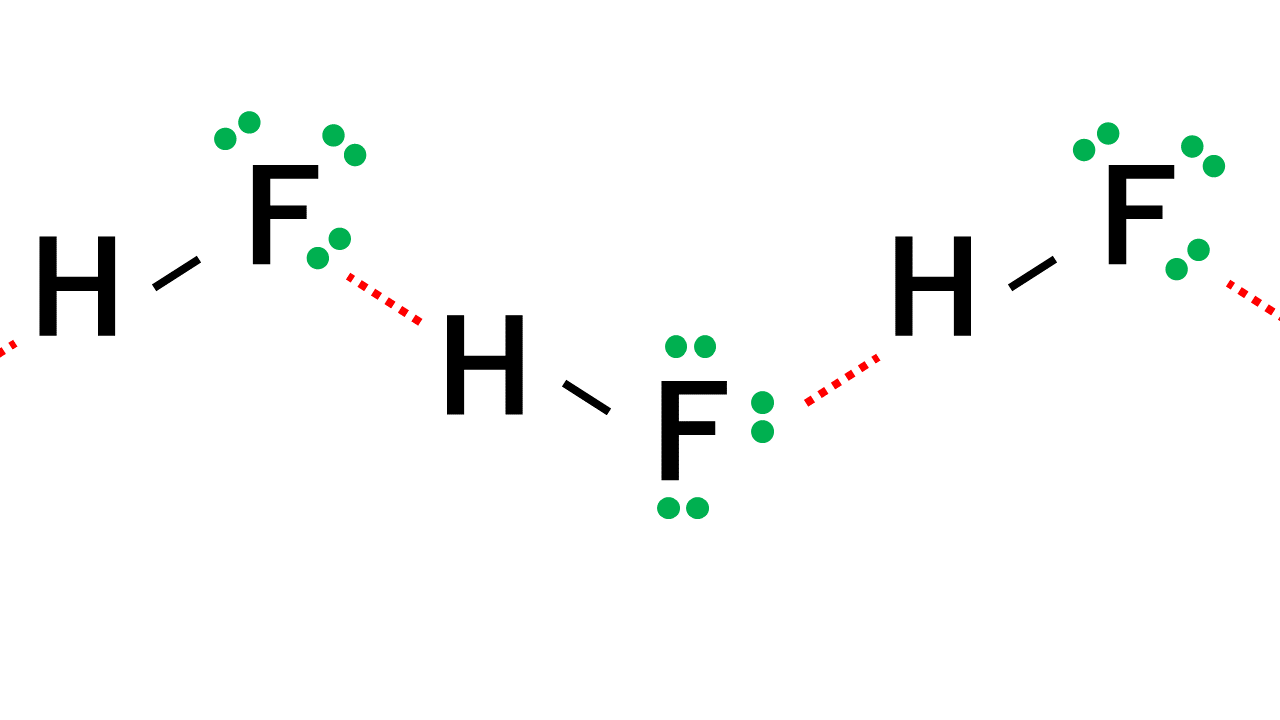 たとえば、フッ化水素が10個あるとすると、鍵(H)が10個、鍵穴(非共有電子対)が30個あるということです。すると、フッ化水素10個につき、鍵(H)が10個と鍵穴(非共有電子対)が10個の組み合わせの結合しか作れません。鍵穴(非共有電子対)が20個余ります。そのため、フッ化水素1分子がもつ鍵1個と鍵穴3個のうち、鍵1個と鍵穴1個が結合に使われるということです。
よって、フッ化水素1分子から生じる水素結合は鍵1個と鍵穴1個分の合計2本の水素結合が生じているということです。ただし、結合1本あたり2分子のフッ化水素で共有しているため、フッ化水素分子1個あたりに換算すると1本の水素結合といえます。
たとえば、フッ化水素が10個あるとすると、鍵(H)が10個、鍵穴(非共有電子対)が30個あるということです。すると、フッ化水素10個につき、鍵(H)が10個と鍵穴(非共有電子対)が10個の組み合わせの結合しか作れません。鍵穴(非共有電子対)が20個余ります。そのため、フッ化水素1分子がもつ鍵1個と鍵穴3個のうち、鍵1個と鍵穴1個が結合に使われるということです。
よって、フッ化水素1分子から生じる水素結合は鍵1個と鍵穴1個分の合計2本の水素結合が生じているということです。ただし、結合1本あたり2分子のフッ化水素で共有しているため、フッ化水素分子1個あたりに換算すると1本の水素結合といえます。
水の水素結合の本数
水は1分子あたり鍵(H)が2つで鍵穴(非共有電子対)が2つある状態です。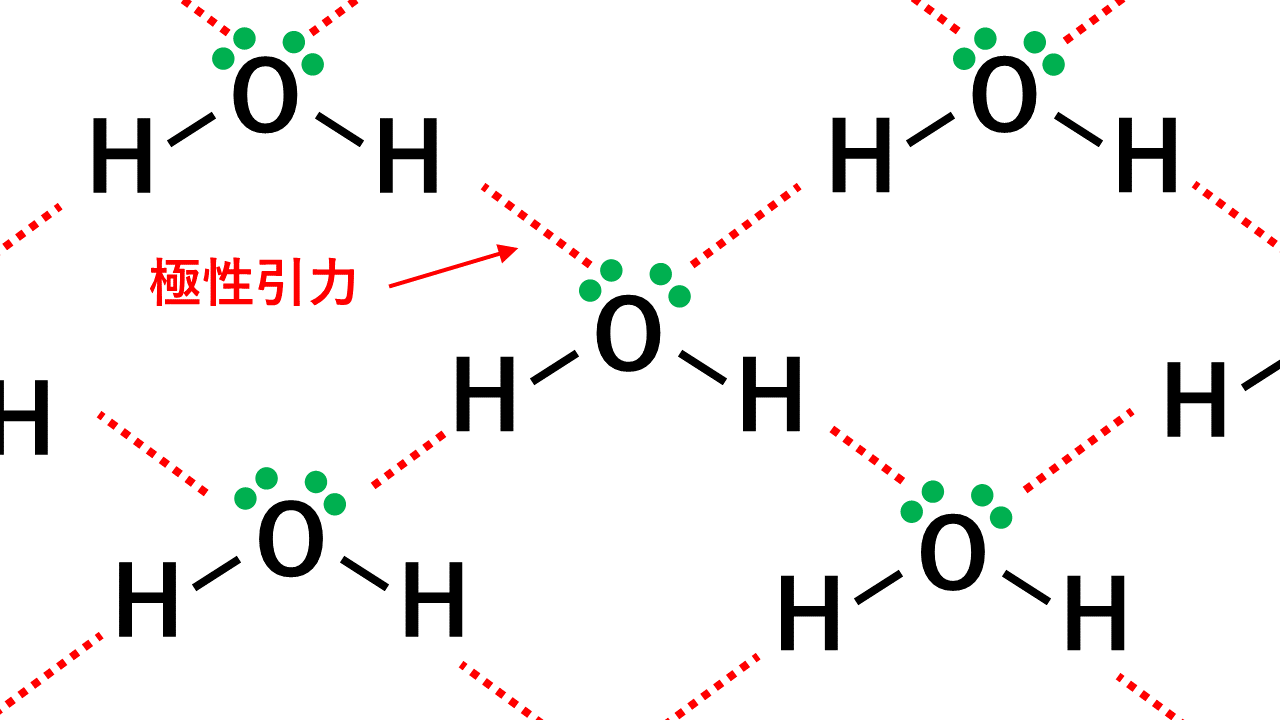 たとえば、水が10個あるとすると、鍵(H)が20個、鍵穴(非共有電子対)が20個あるということです。すると、水10個につき、鍵(H)が20個と鍵穴(非共有電子対)が20個ピッタリの組み合わせの結合が作れます。そのため、水1分子がもつ鍵2個と鍵穴2個すべてが結合に使われるということです。
よって、水1分子から生じる水素結合は鍵2個と鍵穴2個分の合計4本の水素結合が生じているということです。ただし、結合1本あたり2分子の水で共有しているため、水分子1個あたりに換算すると2本の水素結合といえます。
たとえば、水が10個あるとすると、鍵(H)が20個、鍵穴(非共有電子対)が20個あるということです。すると、水10個につき、鍵(H)が20個と鍵穴(非共有電子対)が20個ピッタリの組み合わせの結合が作れます。そのため、水1分子がもつ鍵2個と鍵穴2個すべてが結合に使われるということです。
よって、水1分子から生じる水素結合は鍵2個と鍵穴2個分の合計4本の水素結合が生じているということです。ただし、結合1本あたり2分子の水で共有しているため、水分子1個あたりに換算すると2本の水素結合といえます。
アンモニアの水素結合の本数
アンモニアは1分子あたり鍵(H)が3つで鍵穴(非共有電子対)が1つある状態です。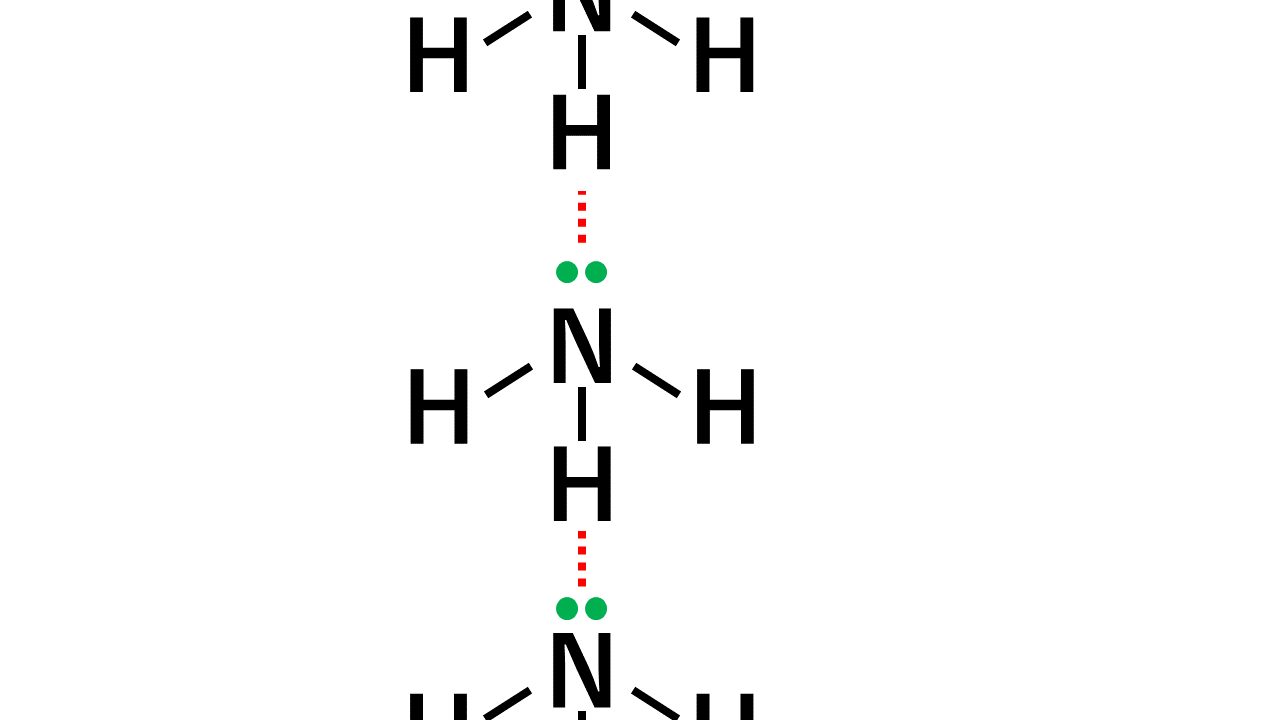 たとえば、アンモニアが10個あるとすると、鍵(H)が30個、鍵穴(非共有電子対)が10個あるということです。すると、アンモニア10個につき、鍵(H)が10個と鍵穴(非共有電子対)が10個の組み合わせの結合しか作れません。鍵穴(非共有電子対)が20個足りません。そのため、アンモニア1分子がもつ鍵3個と鍵穴1個のうち、鍵1個と鍵穴1個が結合に使われるということです。
よって、アンモニア1分子から生じる水素結合は鍵1個と鍵穴1個分の合計2本の水素結合が生じているということです。ただし、結合1本あたり2分子のアンモニアで共有しているため、アンモニア分子1個あたりに換算すると1本の水素結合といえます。
たとえば、アンモニアが10個あるとすると、鍵(H)が30個、鍵穴(非共有電子対)が10個あるということです。すると、アンモニア10個につき、鍵(H)が10個と鍵穴(非共有電子対)が10個の組み合わせの結合しか作れません。鍵穴(非共有電子対)が20個足りません。そのため、アンモニア1分子がもつ鍵3個と鍵穴1個のうち、鍵1個と鍵穴1個が結合に使われるということです。
よって、アンモニア1分子から生じる水素結合は鍵1個と鍵穴1個分の合計2本の水素結合が生じているということです。ただし、結合1本あたり2分子のアンモニアで共有しているため、アンモニア分子1個あたりに換算すると1本の水素結合といえます。
沸点が水H2O > フッ化水素HF > アンモニアNH3となる理由
| フッ化水素 | 水 | アンモニア | |
| 結合1本あたりの強さ | 大 | 中 | 小 |
| 1分子あたりの結合の本数 | 1本 | 2本 | 1本 |
| 沸点 | 中 | 大 | 小 |