【アニメーション解説】分子間力とはファンデルワールス力、極性引力、水素結合の3種類があります。それぞれの違いや仕組み、性質を細かく解説し、ファンデルワールス力が分子量が大きく枝分かれが少ないほど強く働く理由について詳しく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
分子間力とは
分子とは、複数の非金属元素の原子が共有結合してできた「原子のかたまり」です。
そして、分子間に働く引力には三種類の引力があります。
ファンデルワールス力、極性引力、水素結合の三種類です。
そしてその総称が分子間力です。
原子間に働く引力である共有結合や配位結合、金属結合、イオン結合に比べて非常に弱い力です。
ファンデルワールス力とは
ファンデルワールス力とはすべての種類の分子間に働く引力です。つまり、極性分子だけでなく電荷に偏りがない無極性分子どうしでも働きます。
ファンデルワールス力の正体は、瞬間的に生じる極性に基づく静電気力(クーロン力)です。どういうことか説明していきましょう。
無極性分子の場合、電荷に偏りがないため極性引力が生じません。しかし、分子内に存在している電子は軌道内をランダムに動き回っているため、偶然電子が偏ってしまうことがあります。つまり、瞬間的に極性分子のようになるということです。
そうすると隣の分子の電子も、その分子から静電気力(クローン力)を受けて偏ります。近くに正電荷が現れたので引き付けられてしまうということです。このようにして瞬間的に生じた分子の極性に基づいて静電気力(クーロン力)が生じて引き付けあいます。
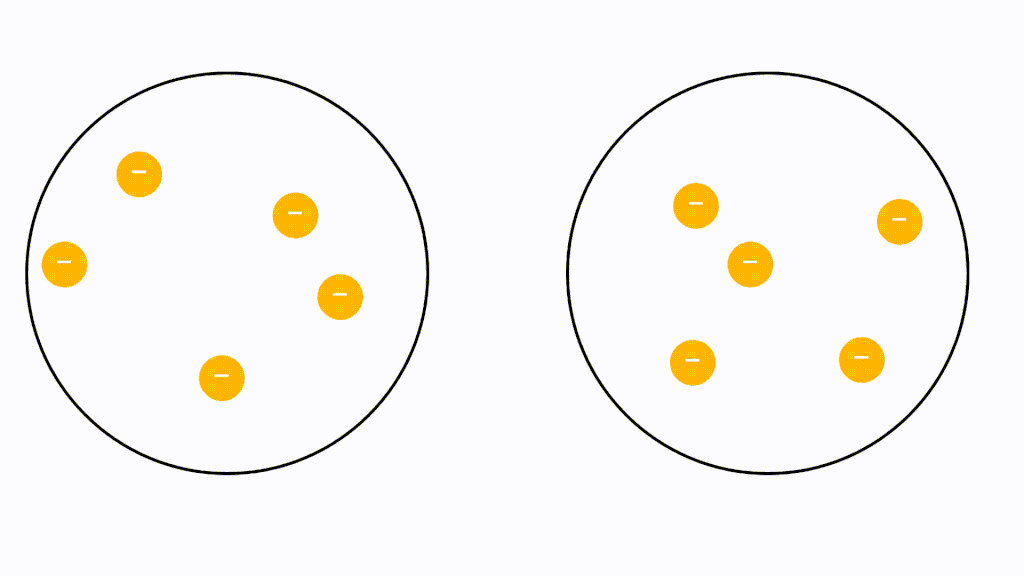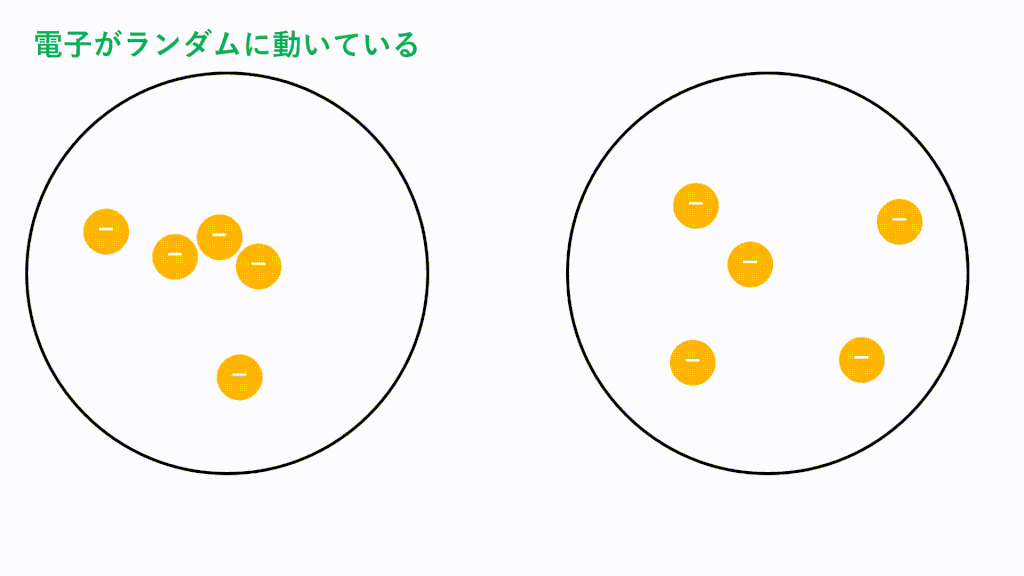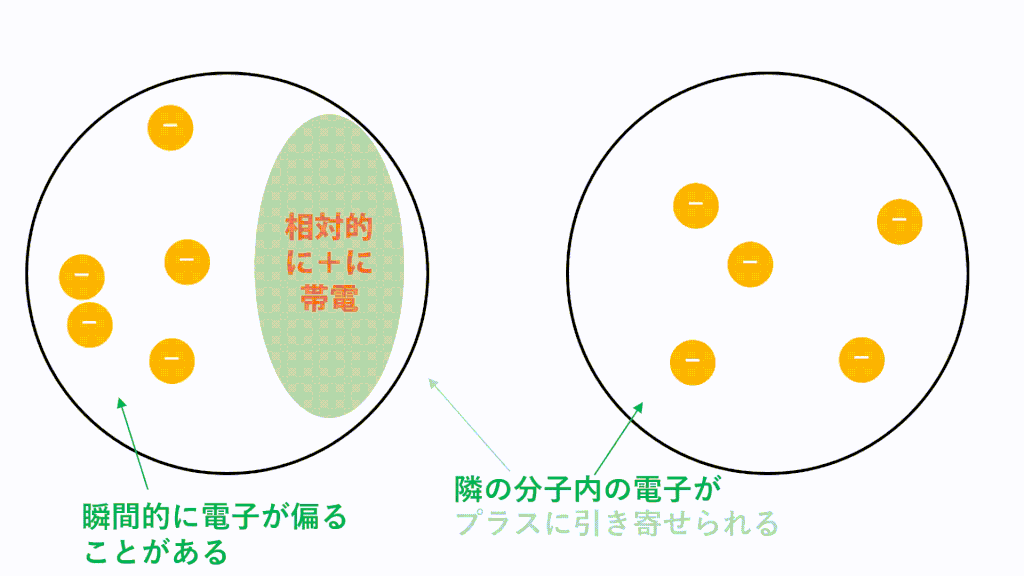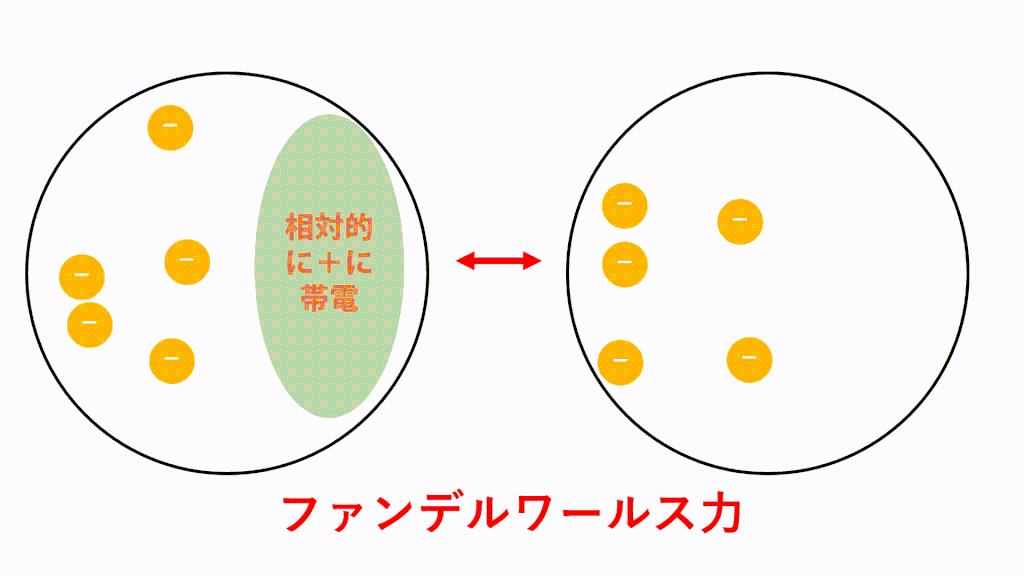
このような仕組みがたえず生じているため、分子間にはたえず瞬間的なクーロン力による引力が働いています。これがファンデルワールス力です。
ファンデルワールス力の強さ
ファンデルワールス力の正体は、瞬間的に生じる極性に基づく静電気力(クーロン力)なので、「電荷が大きく」「距離が近い」ほど強く働きます。
そして、分子間力が強いほど融点・沸点は高くなります。
なぜなら、固体から液体や気体に状態変化するということは分子間力が切れていくということであり、分子間力が強いほどたくさんの熱エネルギーを加えないと結合が切れないからです。
分子量が大きいほどファンデルワールス力は強い
分子量(分子の重さ)が大きいほどファンデルワールス力は強くなります。
その理由は、分子量が大きいということは、陽子や電子をたくさん持っているということであり、電荷をたくさんもっているということです。そうすると、瞬間的に生じる電荷の偏りも全体的に大きくなるからです。
このため、一般的に分子量が大きいほど、ファンデルワールス力が強くなり、融点・沸点が高くなります。
分子の枝分かれが少ないほどファンデルワールス力は強い
分子量以外の要素でファンデルワールス力の強さを決定づけるのは、分子の形状です。
同じ分子式の分子であっても、形状が異なることは少なくありません。(有機化学の分野では当たり前です。)
例えば、ペンタン(分子式はC5H12)の場合、以下のような3つの形状があります。5個の炭素が直線状(直鎖)に並んでHが12個くっついていく形と、Cが4個直線状に並び残り1個のCが枝分かれしている形、Cが3個直線状に並び残り2個のCが枝分かれしている形です。
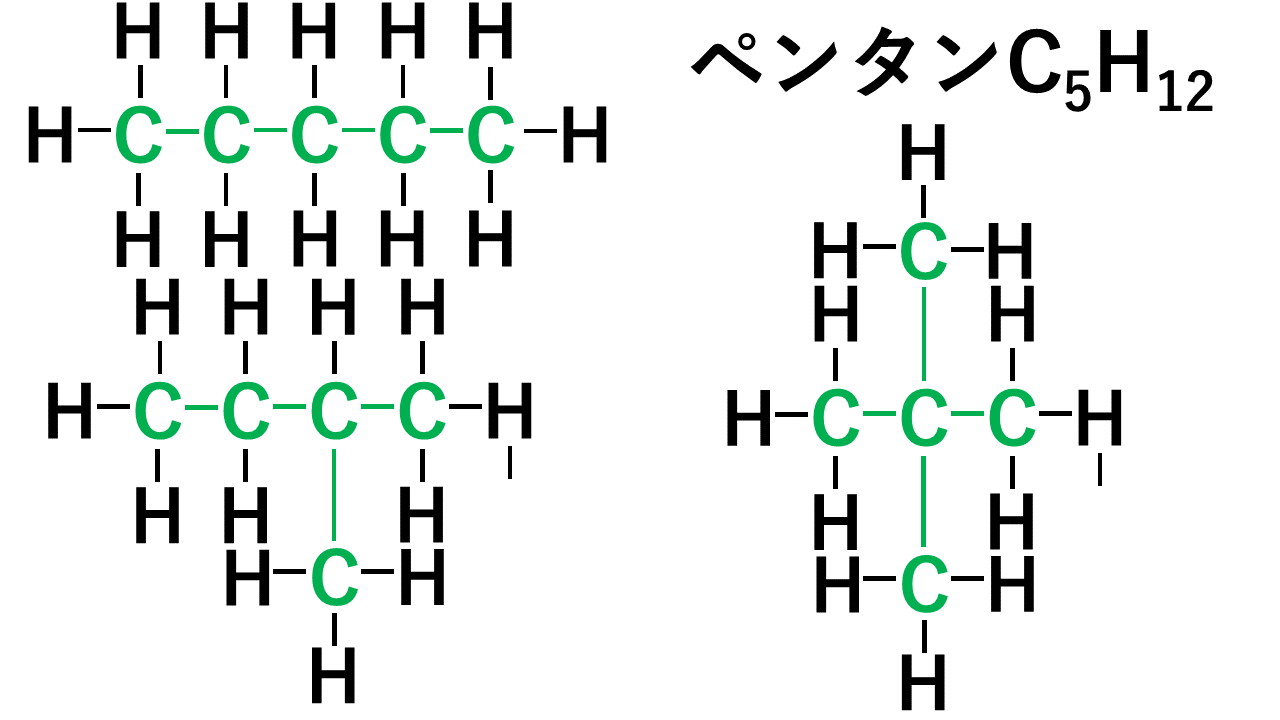
どれもCが5個、Hが12個であることに変わりはありませんが形状が異なります。
そして、細長い直鎖分子の方がファンデルワールス力は強くなり、たくさん枝分かれしている分子のほうがファンデルワールス力は弱くなります。これは、どれだけ分子同士が接近できるかで考えます。分子の形状が細長いと、分子同士はより近づくことができ、接触面積が大きくなりますが、枝分かれが多いと分子同士が近づきにくくなり、接触面積が小さくなります。
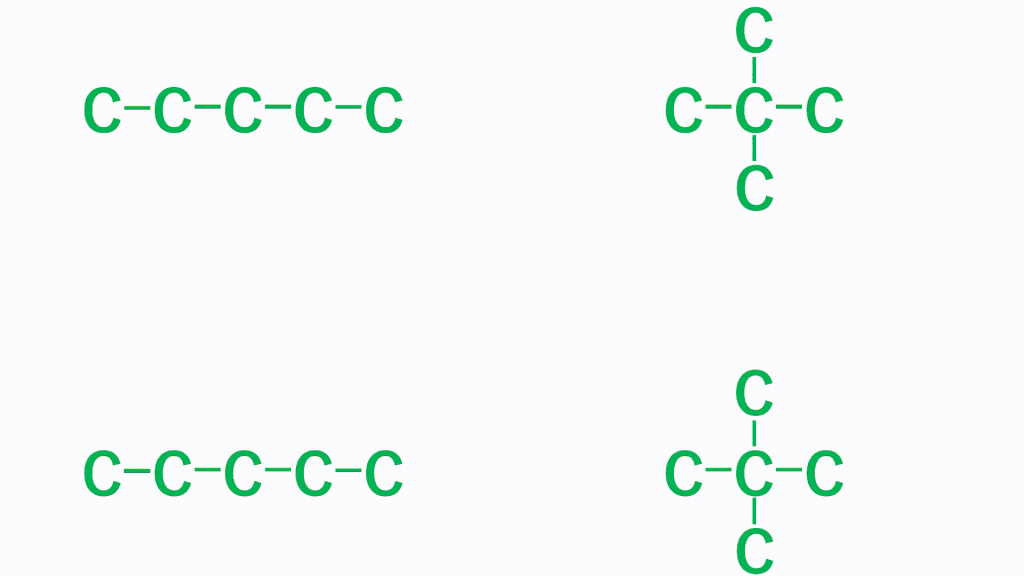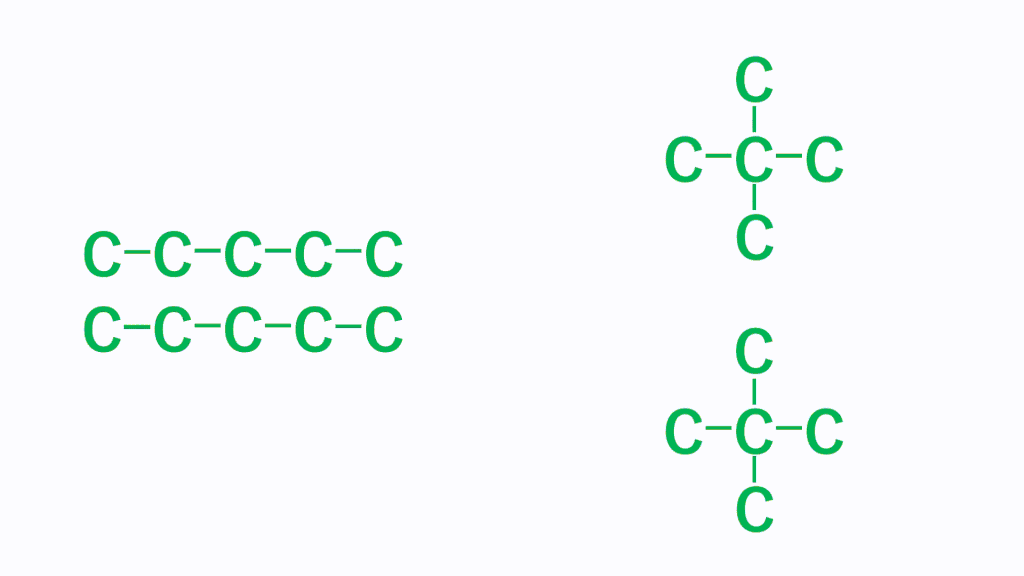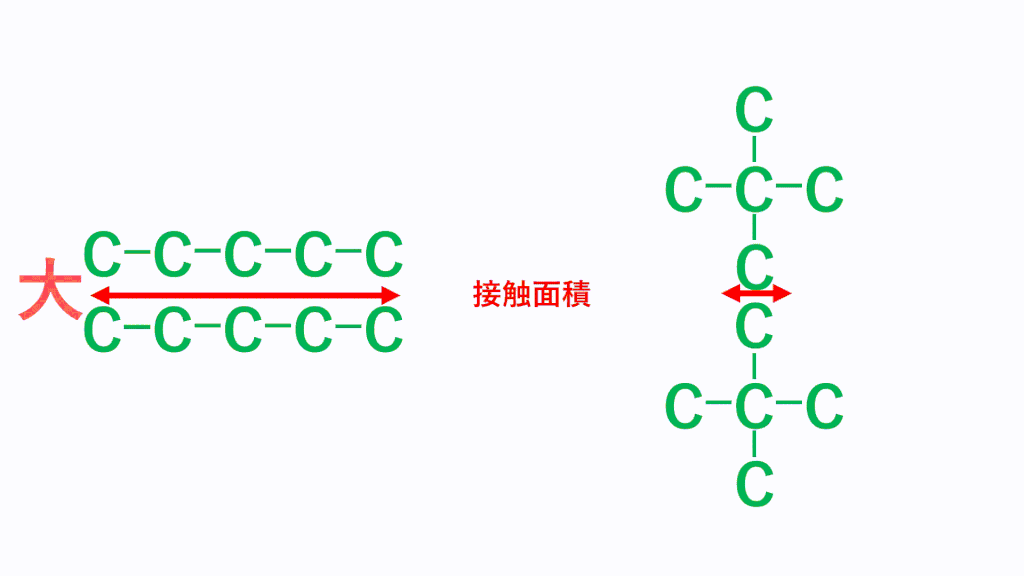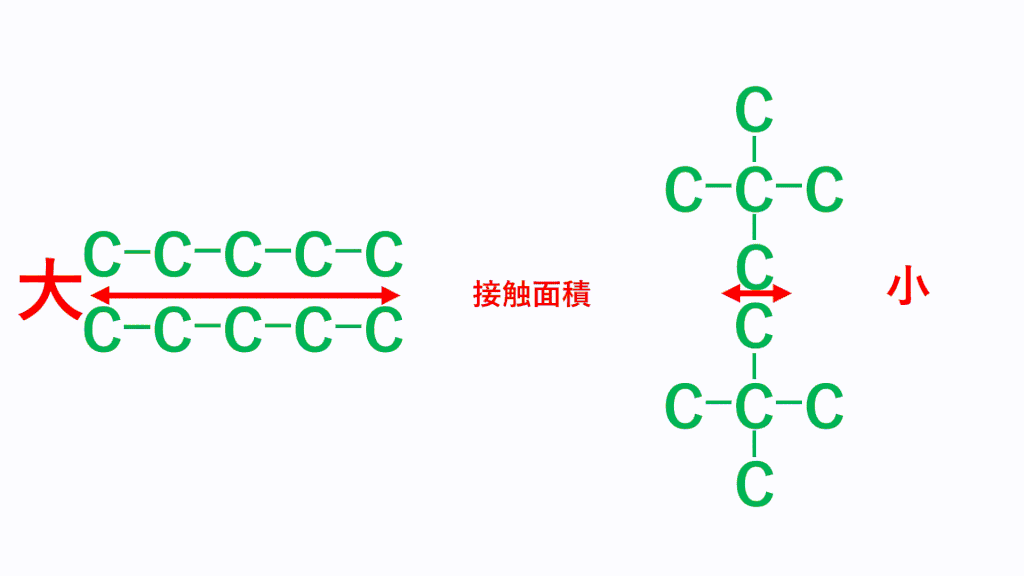
そのため、分子同士の距離が近くなる「細長い直鎖分子」のほうがファンデルワールス力は強くなります。
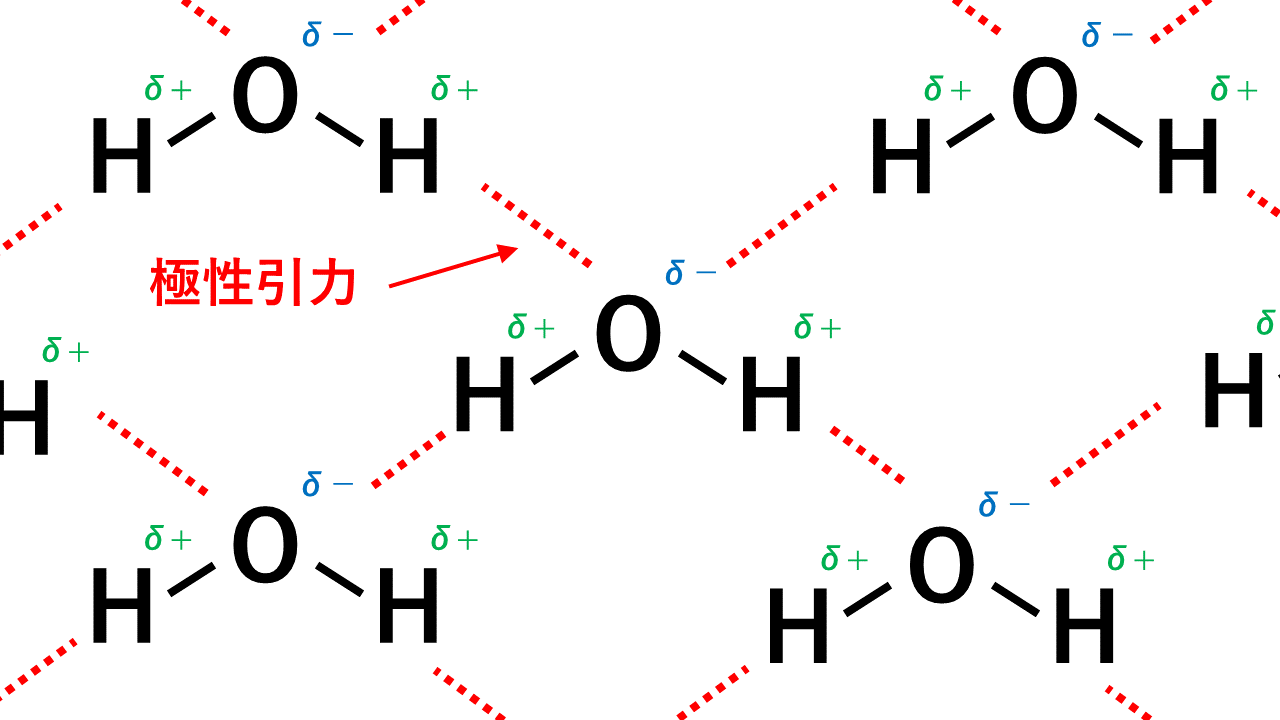
極性引力とは
極性分子どうしには極性引力という力が働き、引き付けあっています。
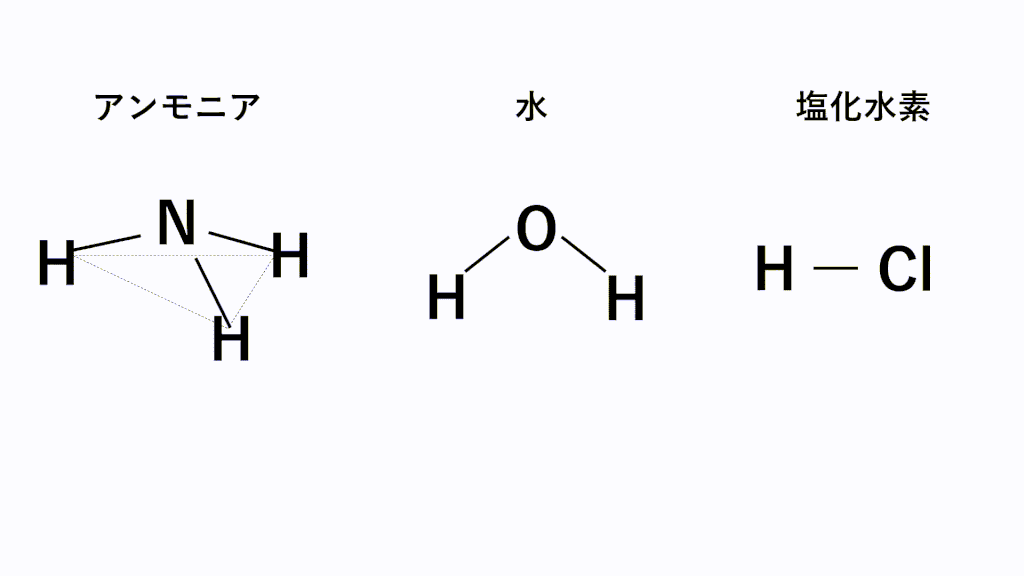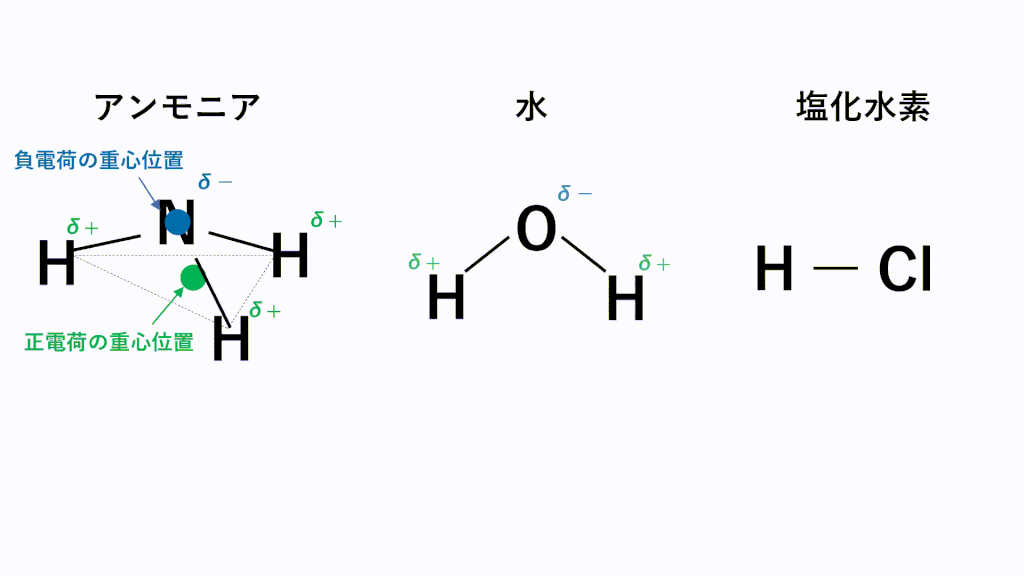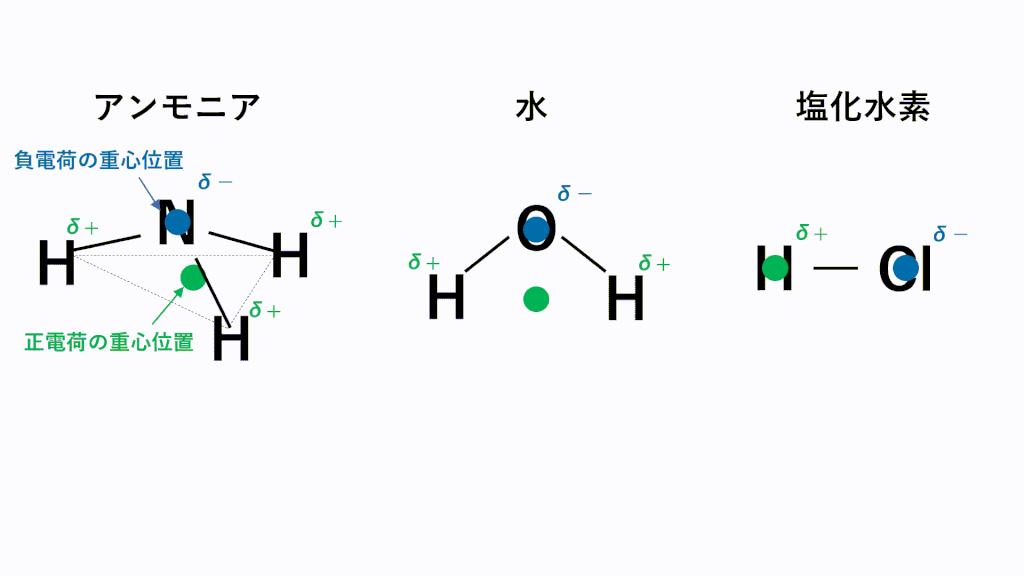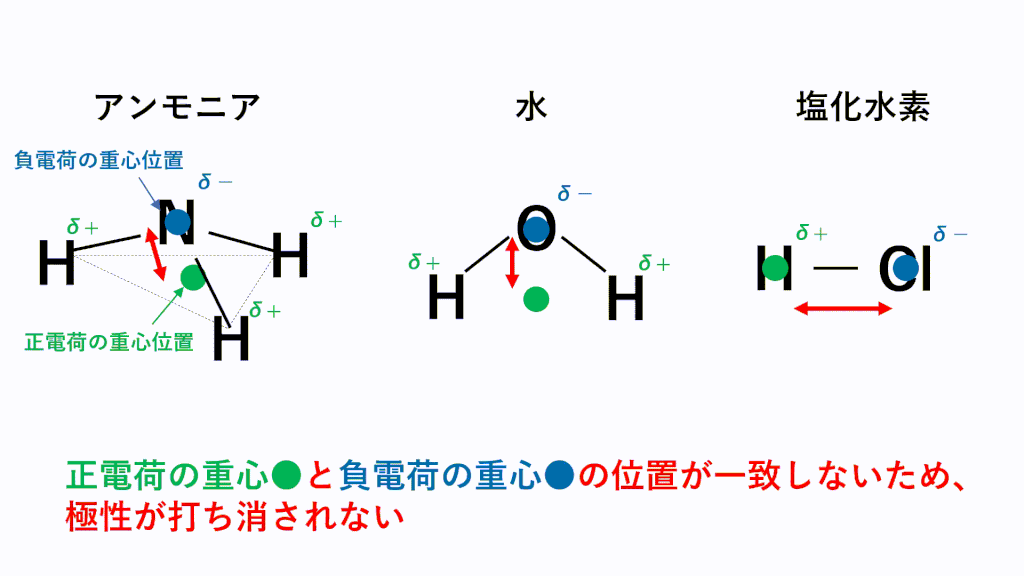
例えばHClの場合、Hがδ+,Clがδ-なので、一つのHCl分子中のH(δ+)と隣のHCl分子のCl(δ-)が引き付けあいます。
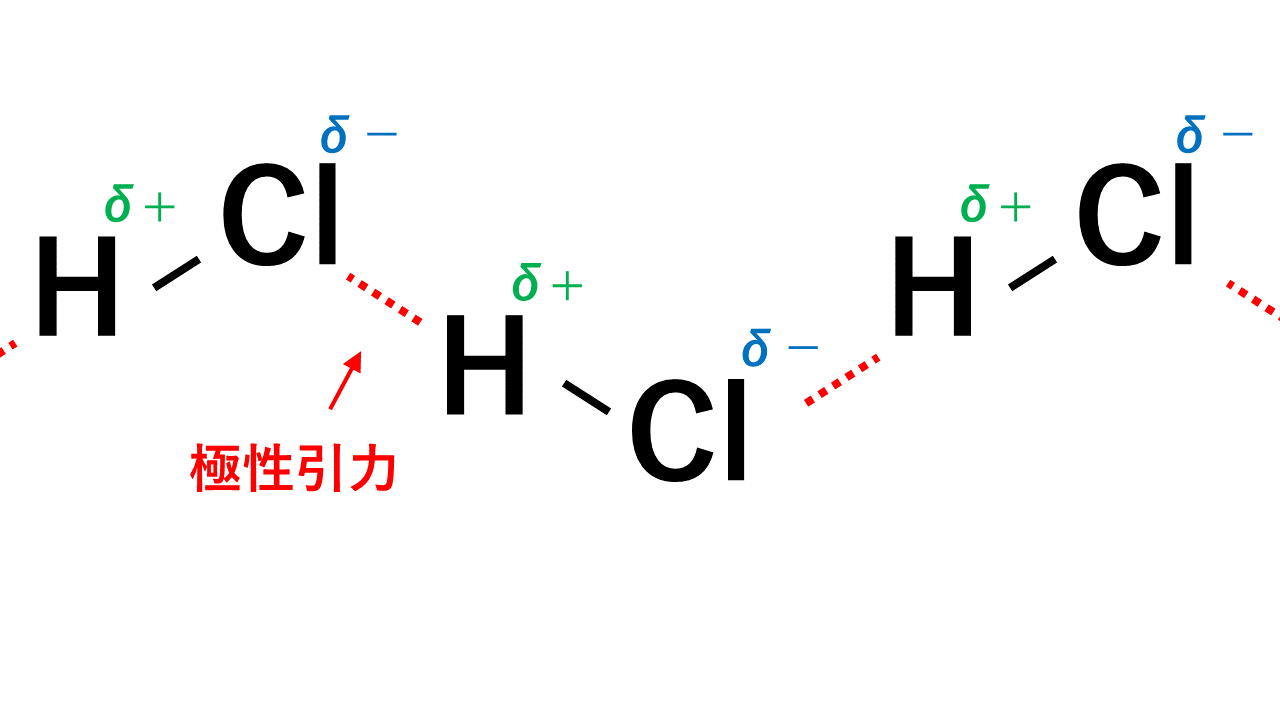
このようにして極性引力が生じます。
水素結合とは
極性分子の中で電気陰性度の差が激しいと極性引力は強くなります。
特に電気陰性度が非常に大きいF,O,N原子とH原子の場合にはたらく極性引力を水素結合といいます。
具体的にはHF(フッ化水素)、H2O(水)、NH3(アンモニア)の3種類を覚えておきましょう。※もちろん他にもエタノールC2H5OHなどたくさんあります。
さいごに
分子間力といえばファンデルワールス力、といわんばかりに極性引力と水素結合のことを意識していない方も多いですが、別の単元でも出てくる概念になりますので、それぞれの違いを理解し、そして繰り返し復習することで覚えておきましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。