【アニメーション付き解説】共有結合の仕組み、単結合、二重結合、三重結合の違いと水、アンモニア、メタン、二酸化炭素という具体例を用いて電子式、構造式、分子式の違いをビジュアルで分かりやすく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
共有結合とは
2個の原子がそれぞれ不対電子を出し合って電子対をつくり,この電子対が2個の原子に共有されることによってできる結合を共有結合といいます。
非金属原子と非金属原子が結合するときに生じます。
※電子式や電子対について理解していない人は 電子式の書き方と一覧を解説!構造式と分子式の違いまで を参照してください。
結合の仕組み
例えば、フッ素Fは最外殻電子が7個あり、電子対が3組と不対電子が1つという状況です。
このとき各原子が不対電子を1個ずつ出し合って共有すると、共有結合という結合になり、フッ素分子F2となります。
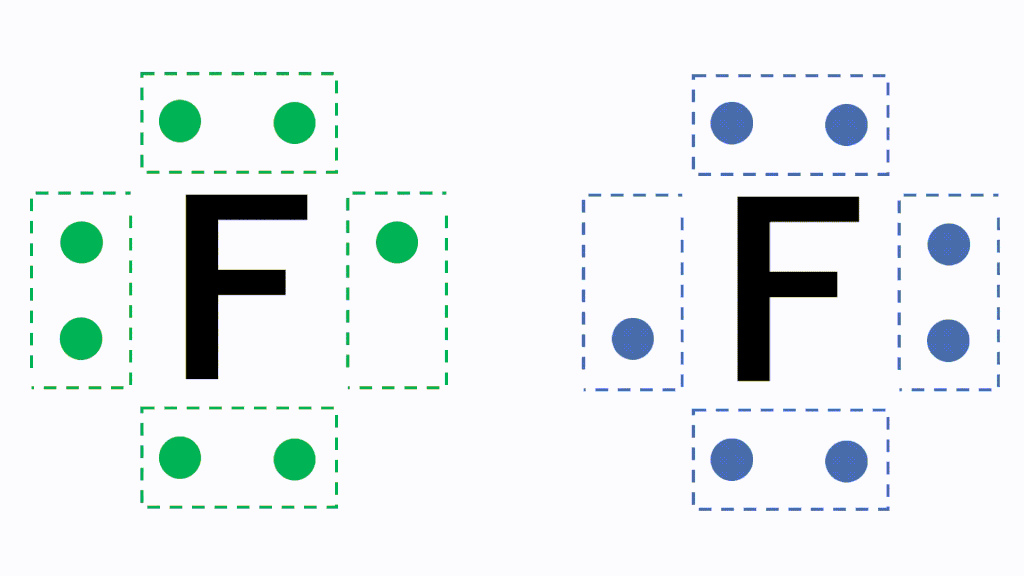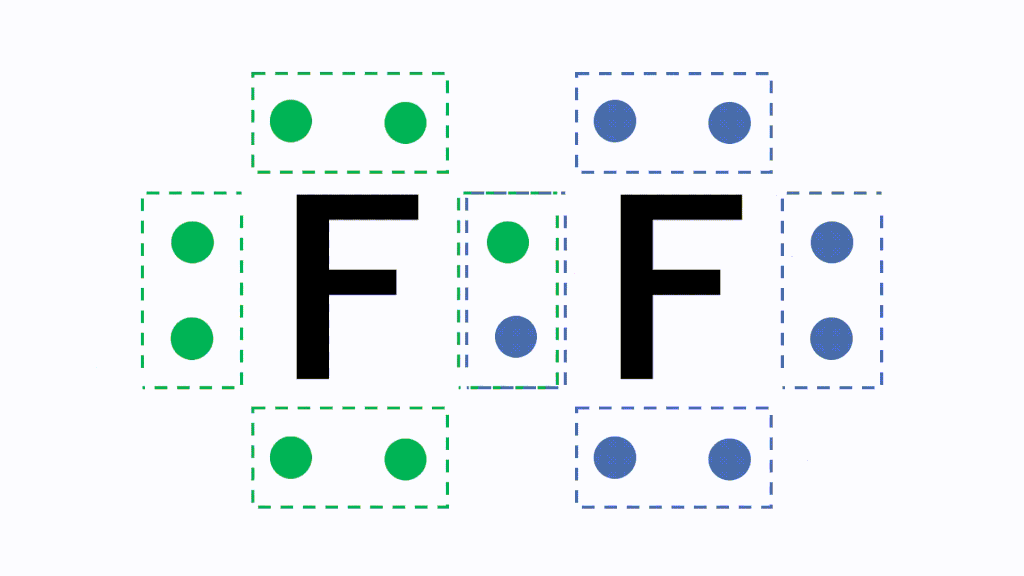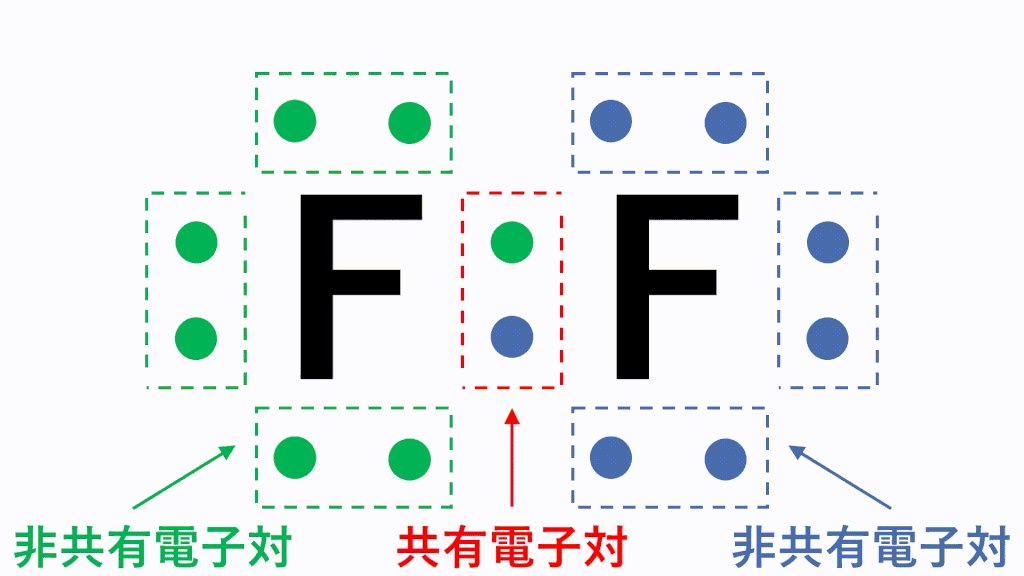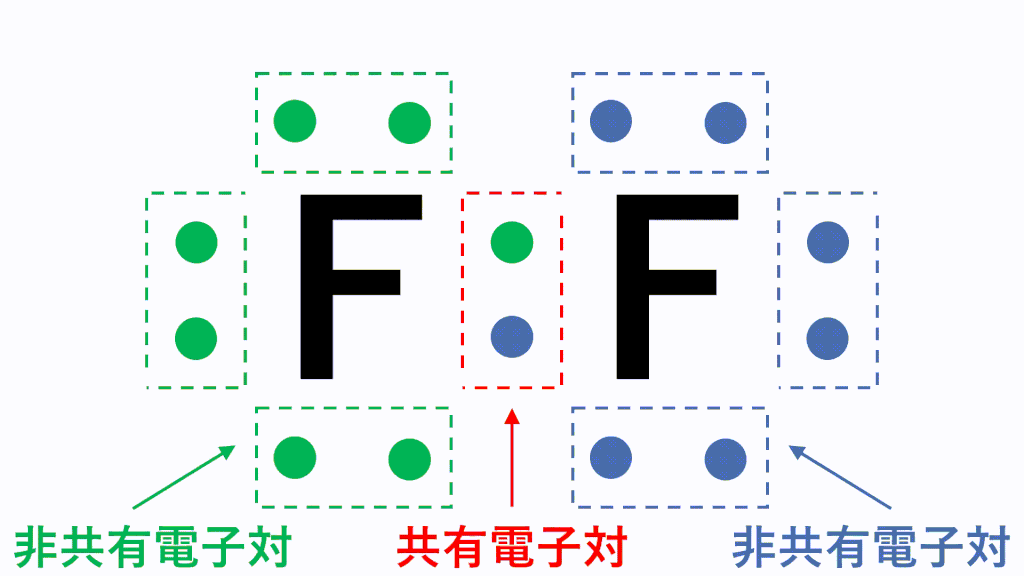
分子の電子式に含まれる電子対のうち、2つの原子が電子を1コずつ出し合うことで形成される電子対を共有電子対、1つの原子が持つ電子のみで形成される電子対を非共有電子対といいます。
なぜこのように不対電子を出し合う必要があるかというと、原子のままだと最外殻電子が7個で不安定だからです。あと電子が1個あればネオンNeと同じ電子配置のオクテットとなり安定的になります。そのため、フッ素原子同士で不対電子を出し合い共有します。
※忘れた人は、電子配置の書き方を解説!一覧(周期表)付き を参照してください。

すると、どちらの原子にとっても8個ずつ持っている状態に見えますので、安定的に存在することができます。これが共有結合です。
このように、原子どうしが共有結合しかたまりになった状態を分子といいます。
共有結合は、非金属原子どうしが、互いの最外殻電子数を8個にしようとして生じるものなので、元々持っている最外殻電子数によって共有電子対の数が変わります。
結合の種類
単結合 :1組の共有電子対による共有結合(例:水素分子H2)
二重結合:2組の共有電子対による共有結合(例:酸素分子O2)
三重結合:3組の共有電子対による共有結合(例:窒素分子N2)
単結合について
先ほどのフッ素F2のように、原子間が1つの共有電子対による結合が単結合です。
もう一度結合の仕組みを確認しましょう。

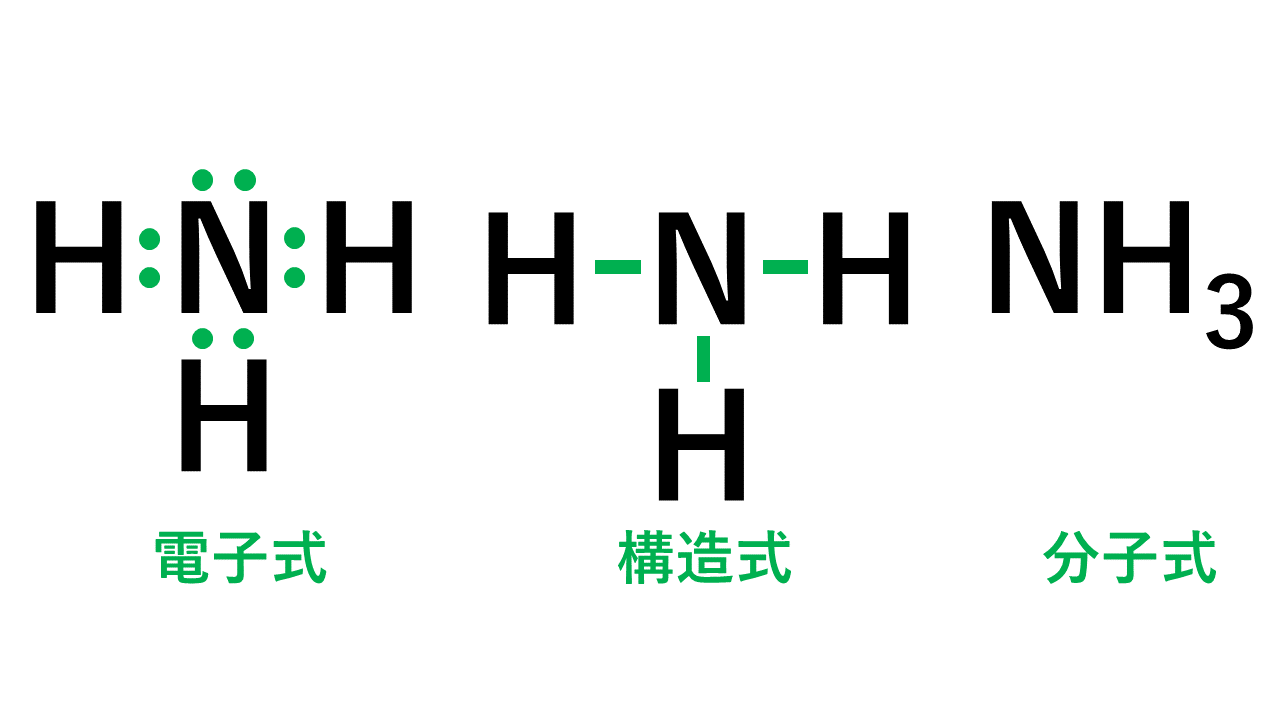
そして、以下が電子式、構造式、分子式の具体例です。
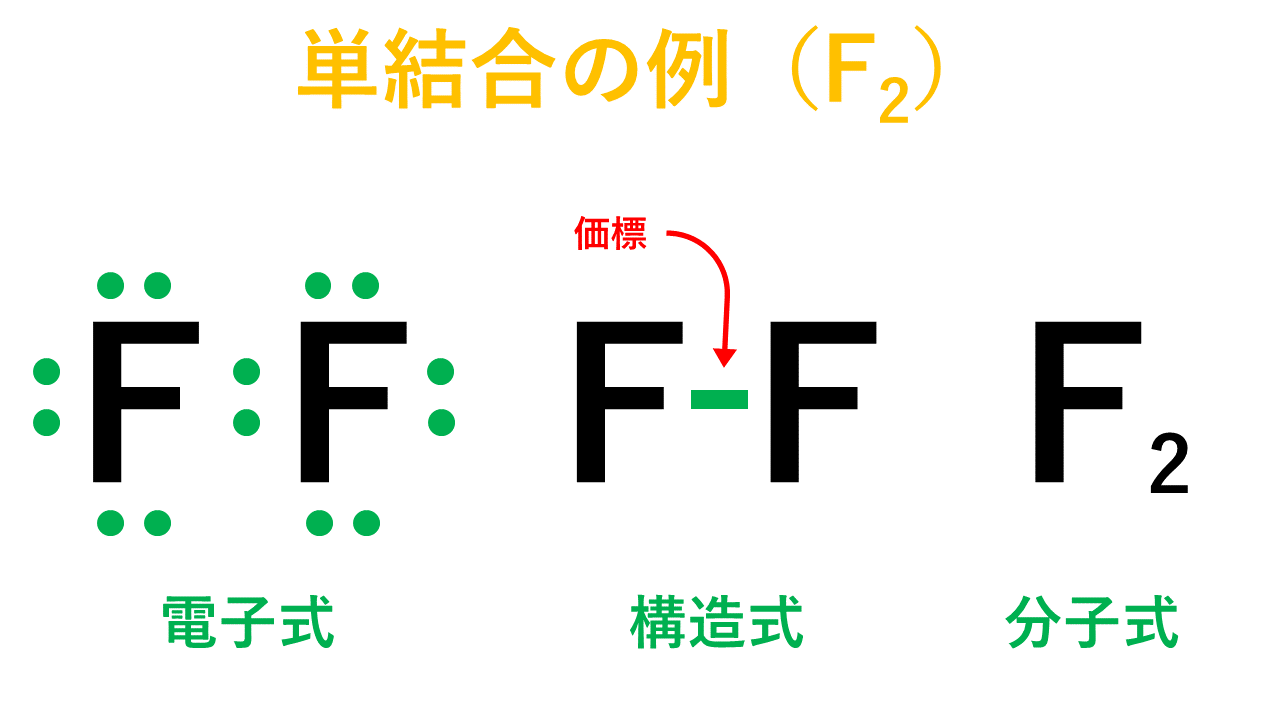
電子式のうち、1組の共有電子対を線分で表したものを構造式といいます。
このとき、線分のことを価標といい、非共有電子対は省略するのが構造式を書く際のルールです。
分子を構成する原子の数を表しただけのものが分子式です。
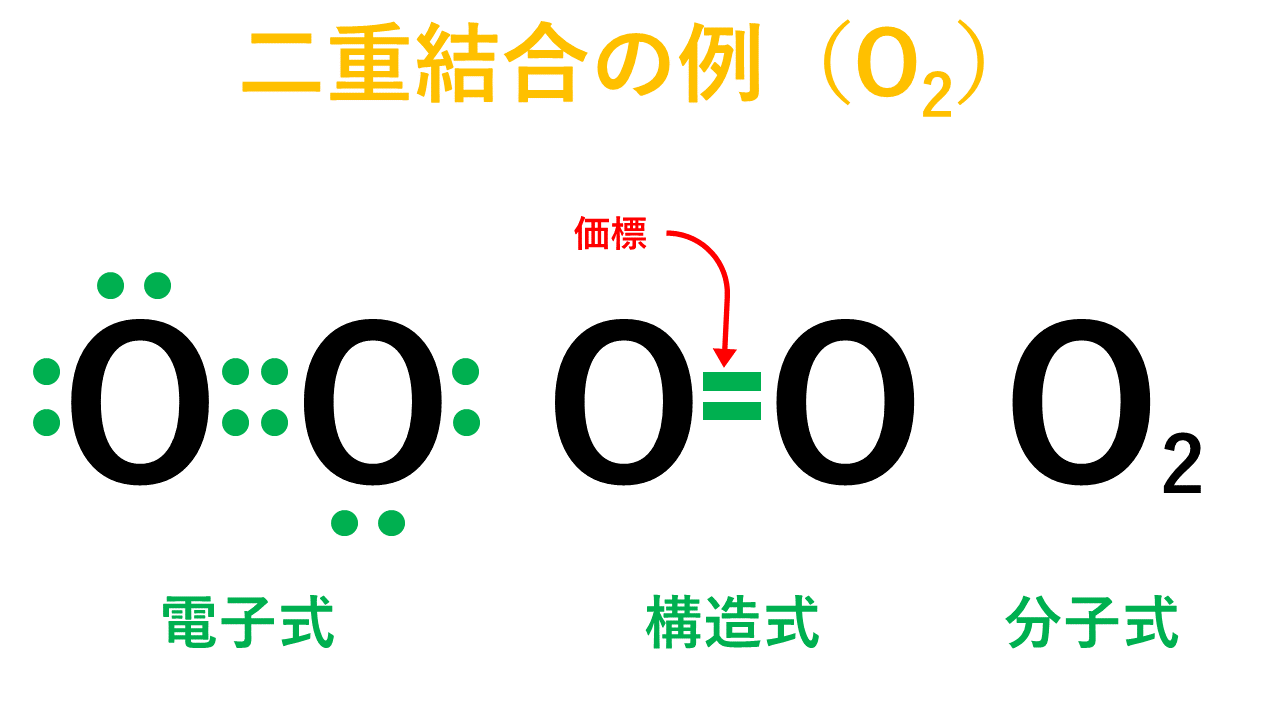
二重結合について
Oの場合だと、最外殻電子数が6でオクテットまであと2つの状態です。酸素分子を形成する際、Oは互いに電子を2個ずつ出し合って2組の共有電子対をつくって結合します。これが二重結合です。
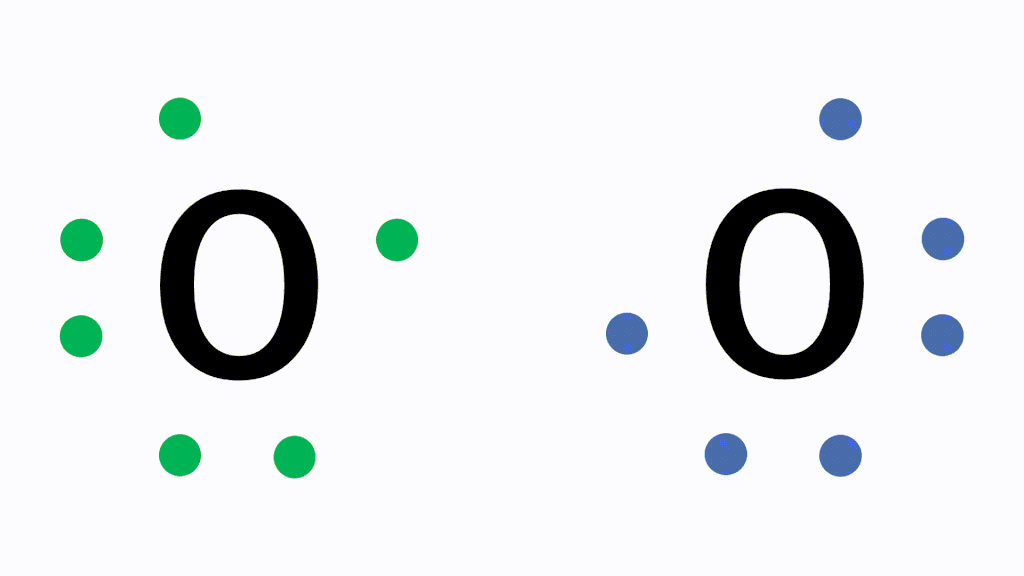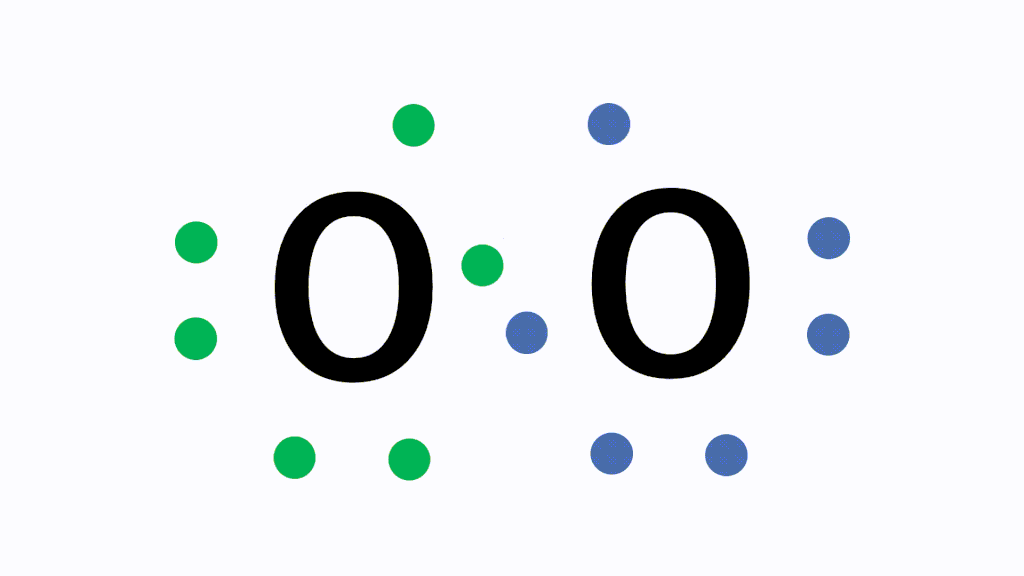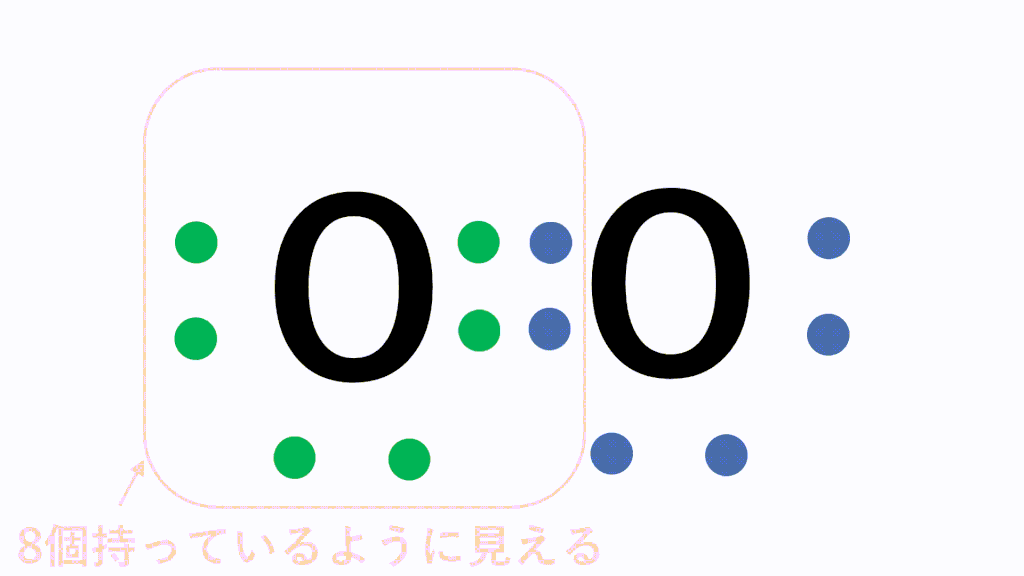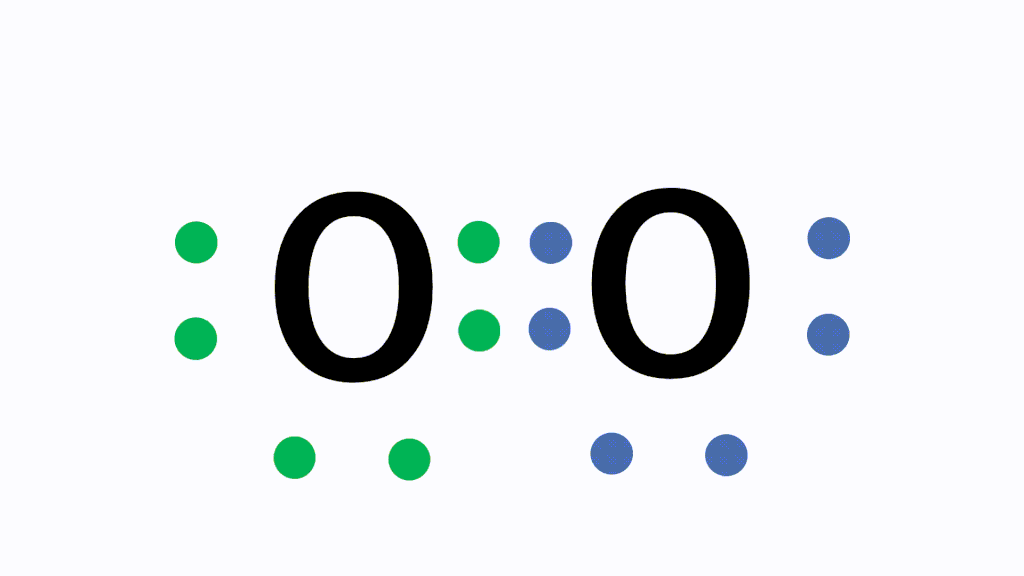
そして、以下が電子式、構造式、分子式の具体例です。
三重結合について
Nの場合だと、最外殻電子数が5でオクテットまであと3つの状態です。窒素分子を形成する際、Nは互いに電子を3個ずつ出し合って3組の共有電子対をつくって結合します。これが三重結合です。

そして、以下が電子式、構造式、分子式の具体例です。
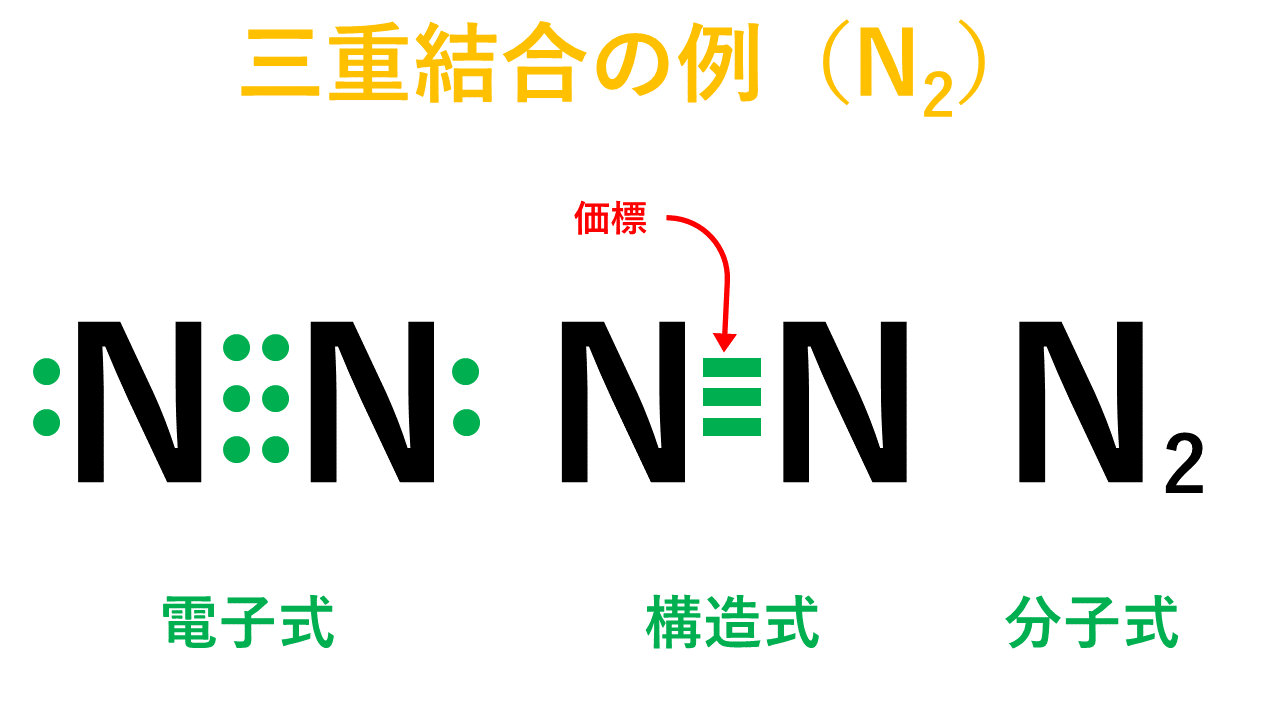
頻出の共有結合の具体例
共有結合は異なる種類の非金属原子間にも生じます。
例えば、H2O(水)、NH3(アンモニア)、CH4(メタン)、CO2(二酸化炭素)を考えてみましょう。
これらの分子の中でも各原子がオクテットになるように電子が共有されます。
具体的に見てみましょう。
H2O(水)の電子式について
以下のように各原子は閉殻構造をとります。
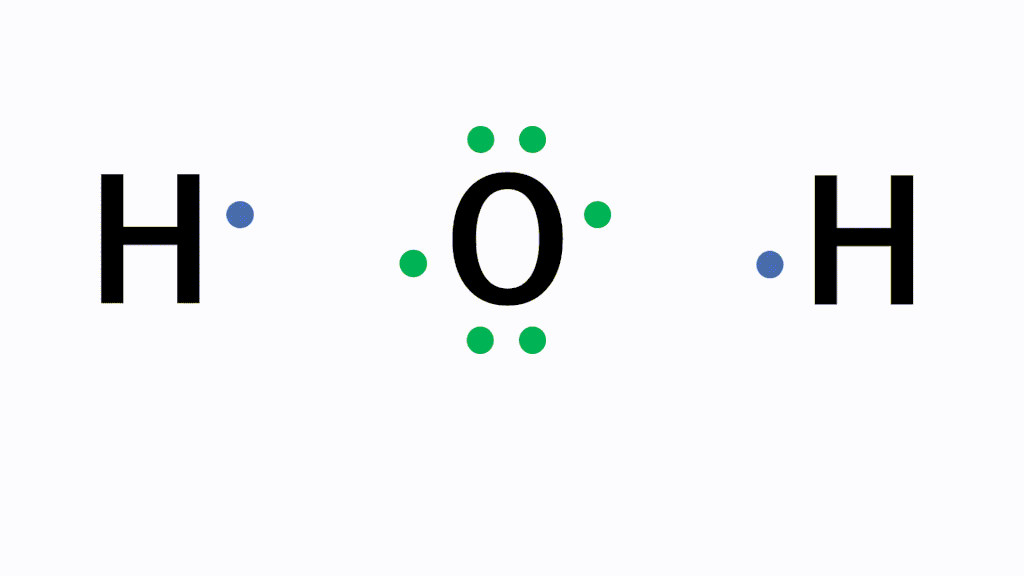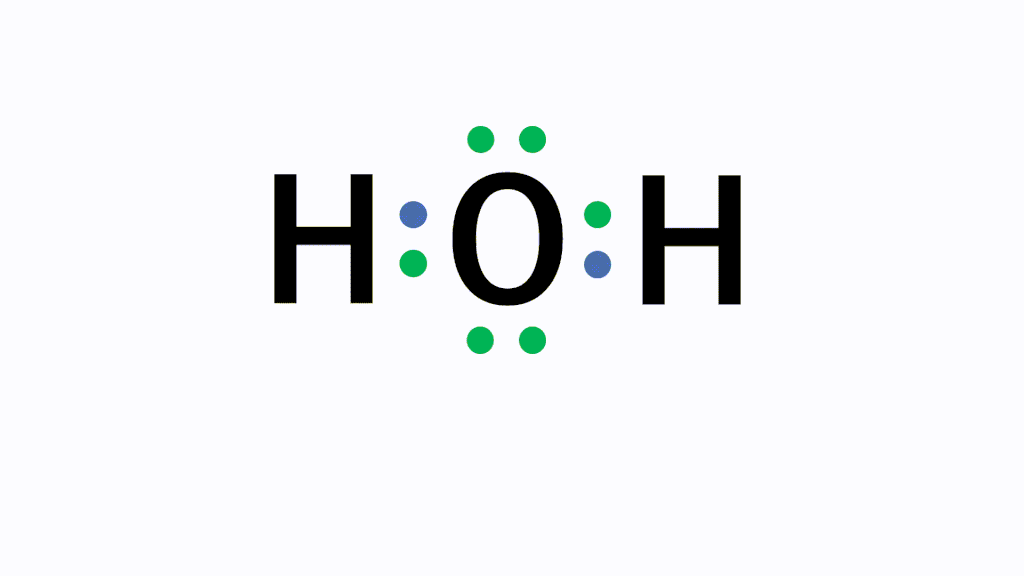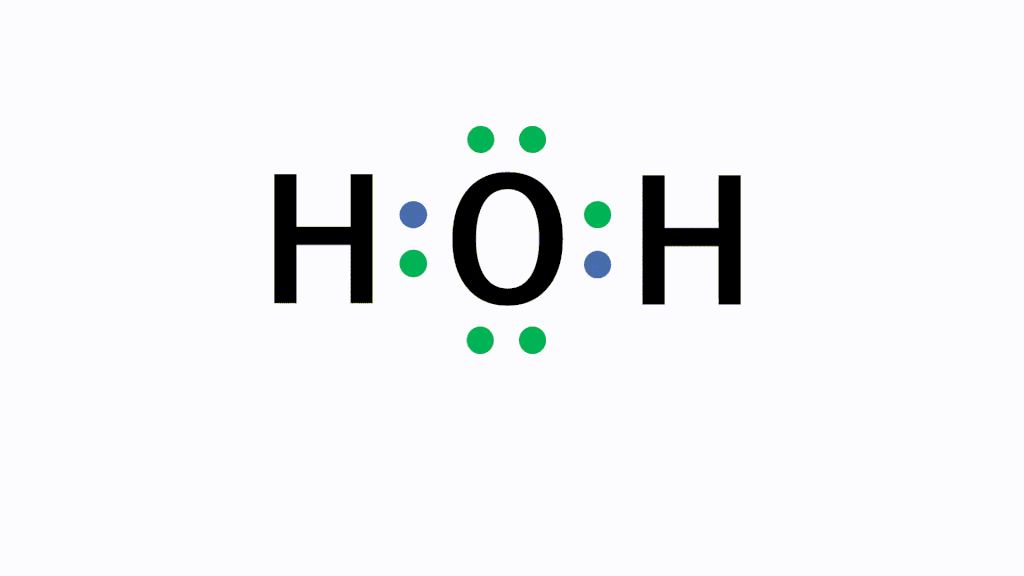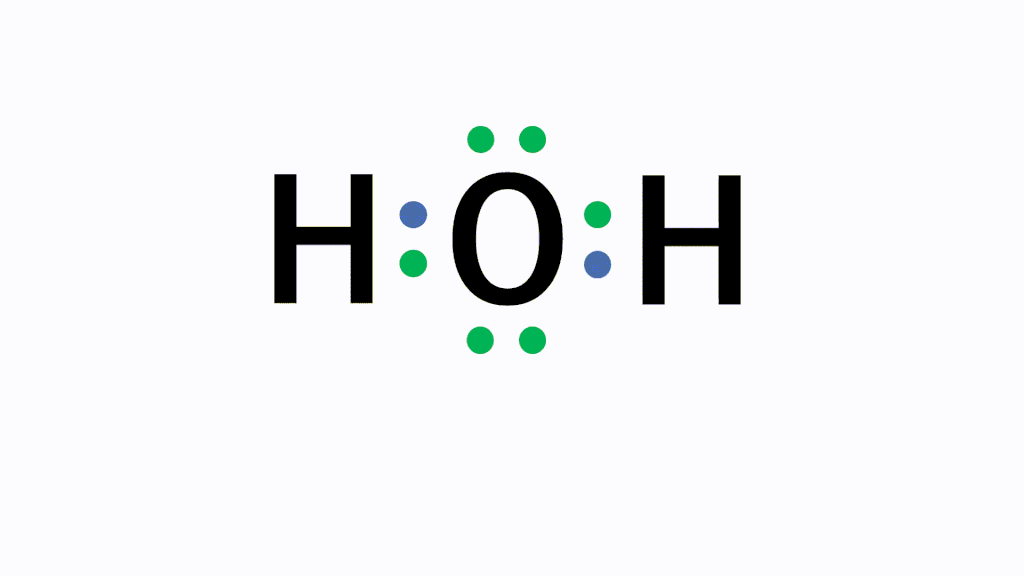
Hは第1周期なので最外殻電子数が2個、Oは8個になっています。

NH3(アンモニア)の電子式について
以下のように各原子は閉殻構造をとります。
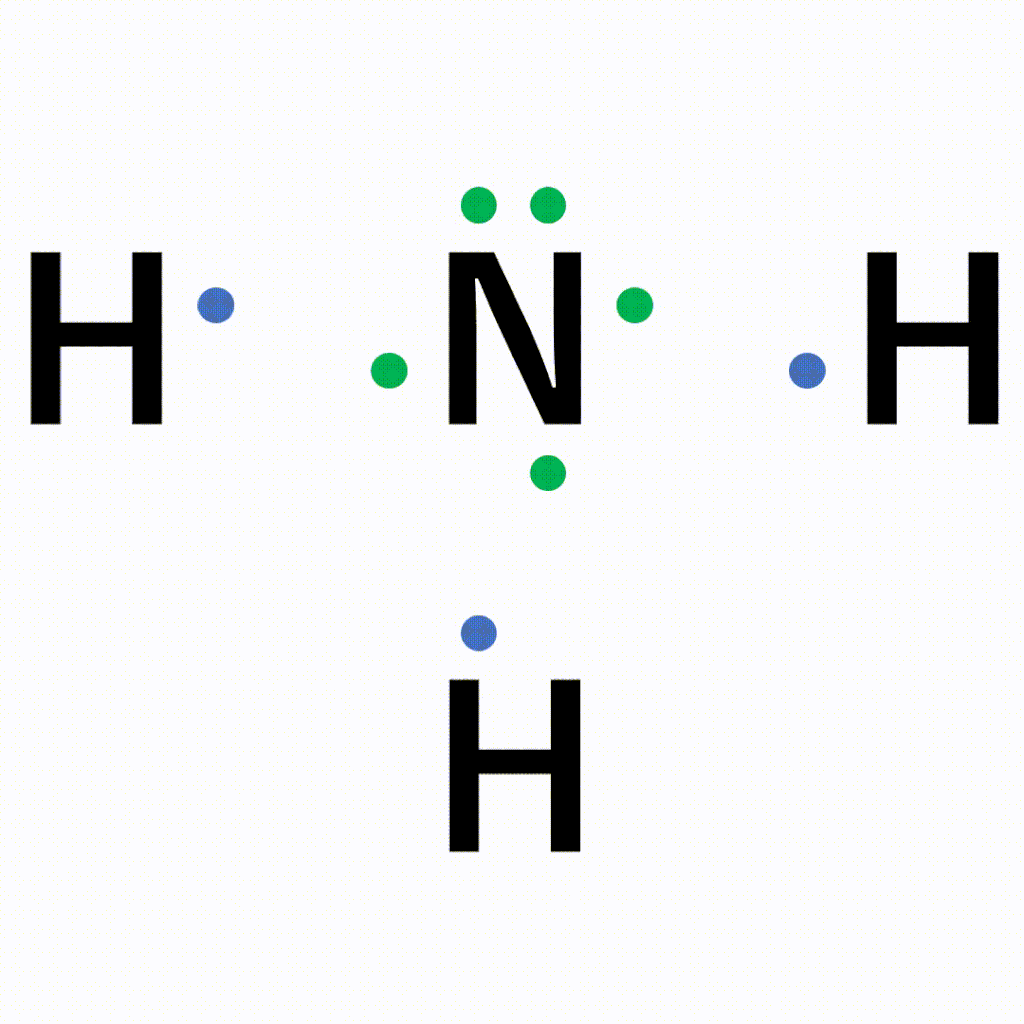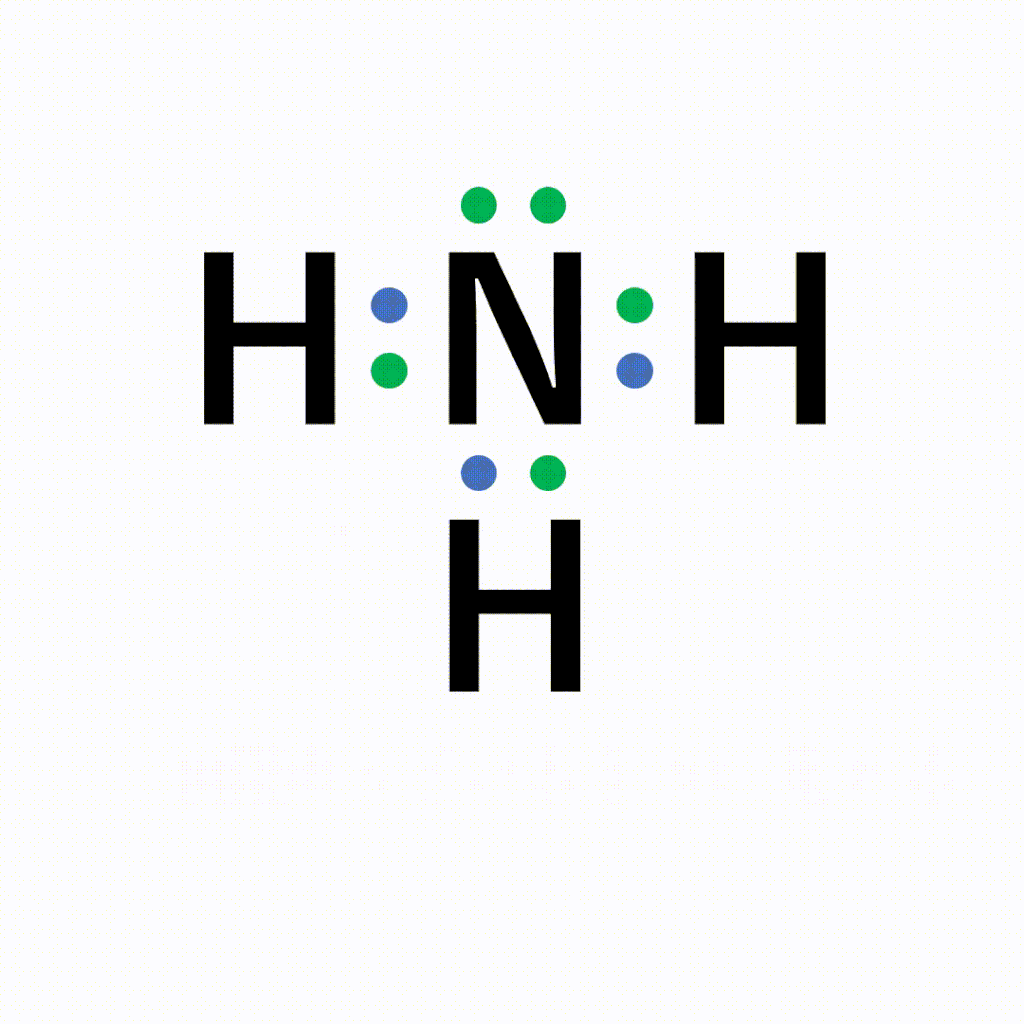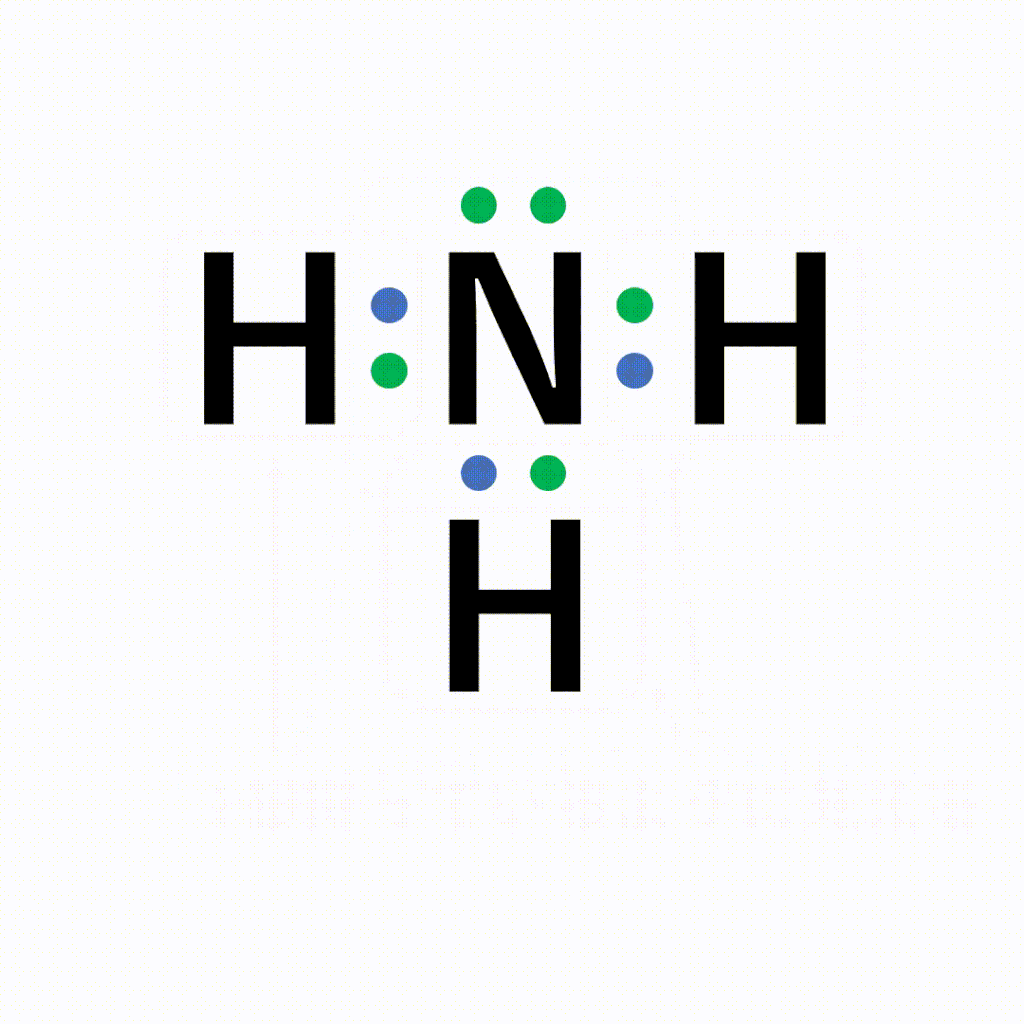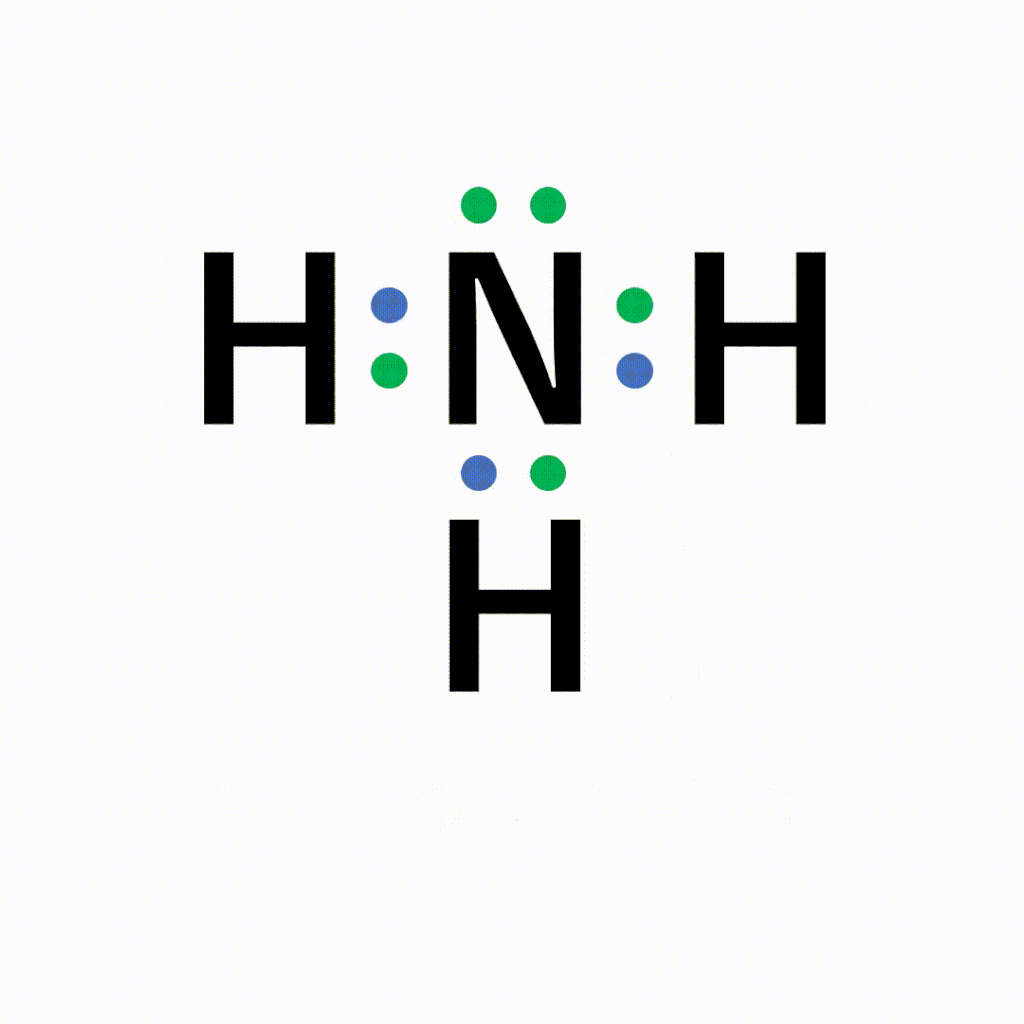
Hは第1周期なので最外殻電子数が2個、Nは8個になっています。
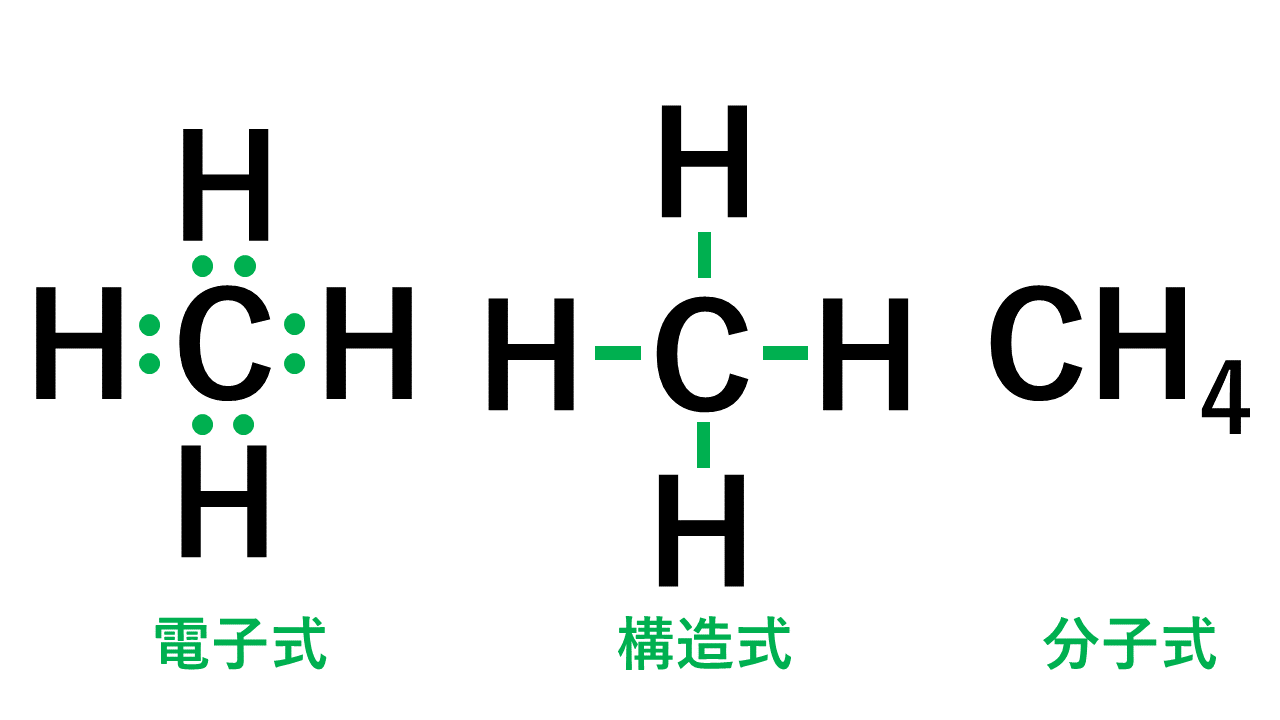
CH4(メタン)の電子式について
以下のように各原子は閉殻構造をとります。
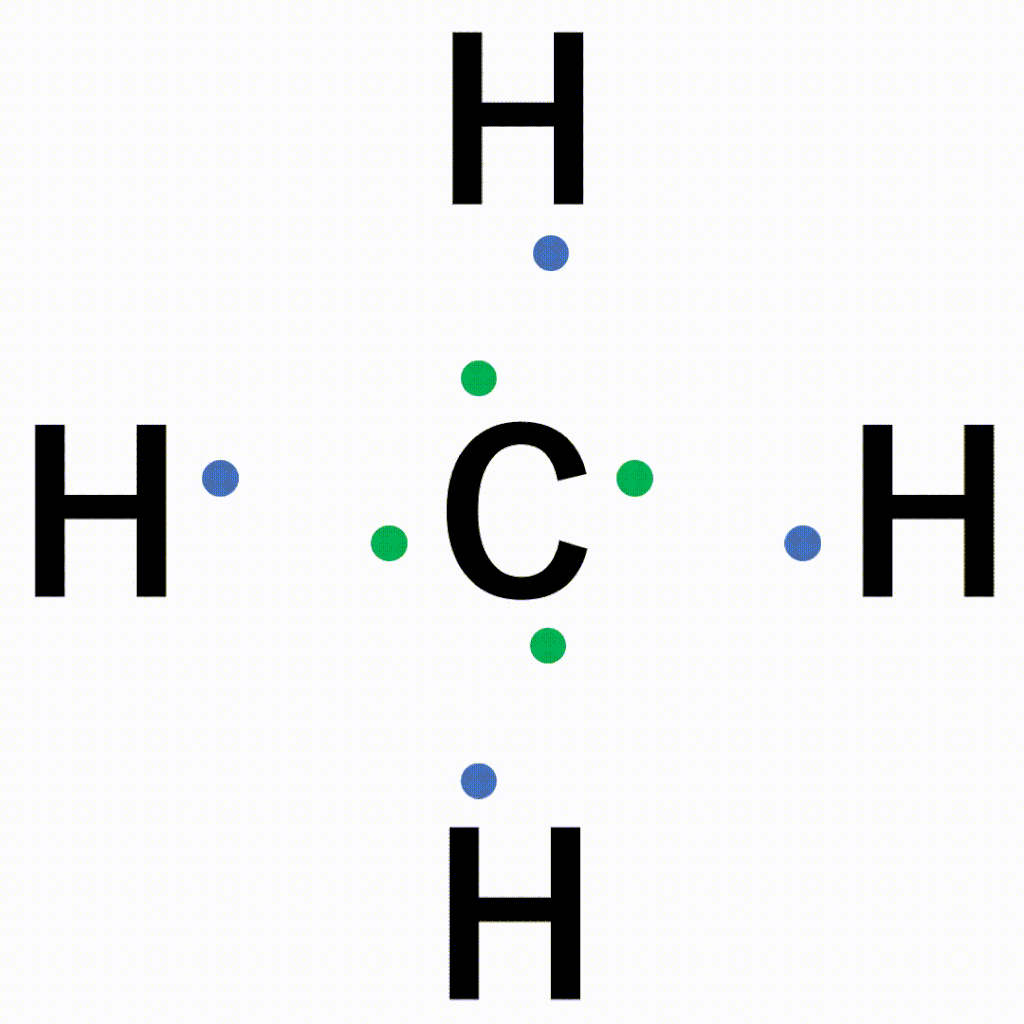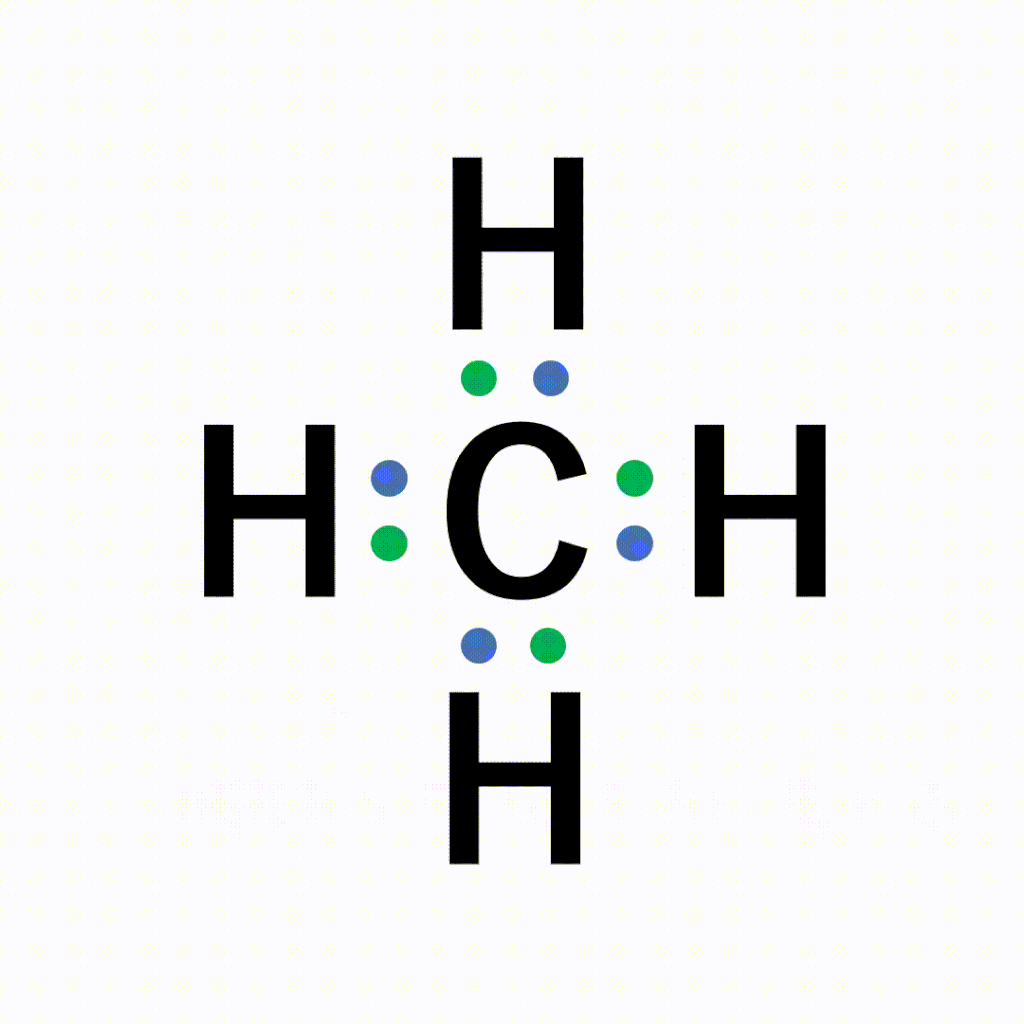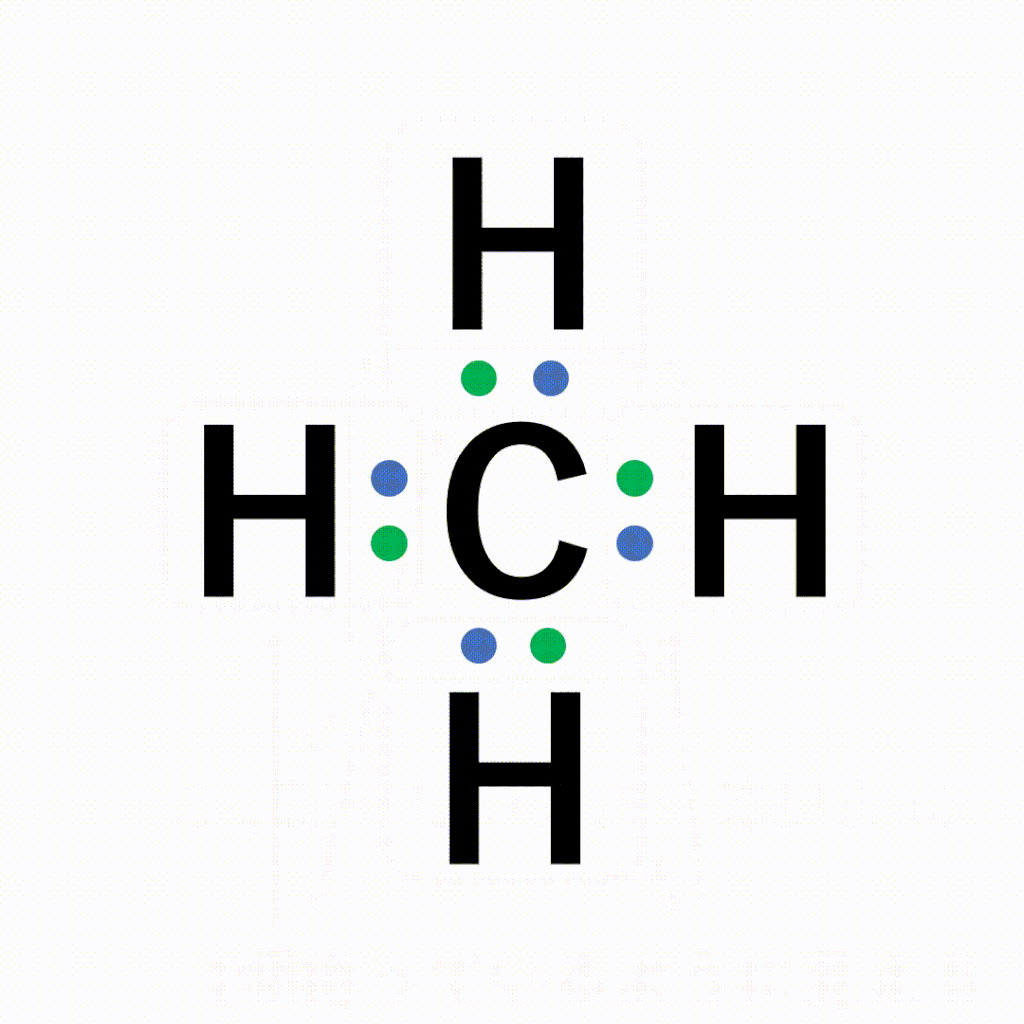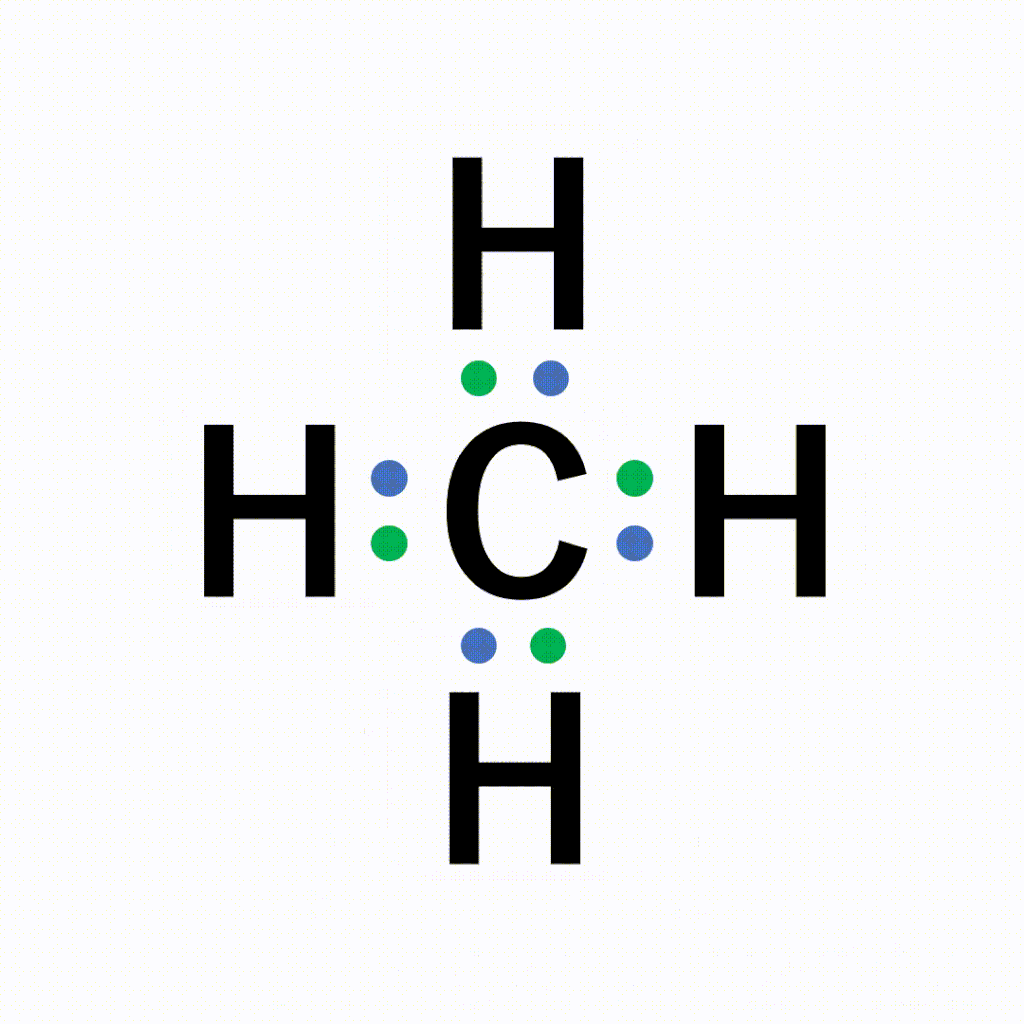
Hは第1周期なので最外殻電子数が2個、Cは8個になっています。
CO2(二酸化炭素)の電子式について
以下のように各原子は閉殻構造をとります。
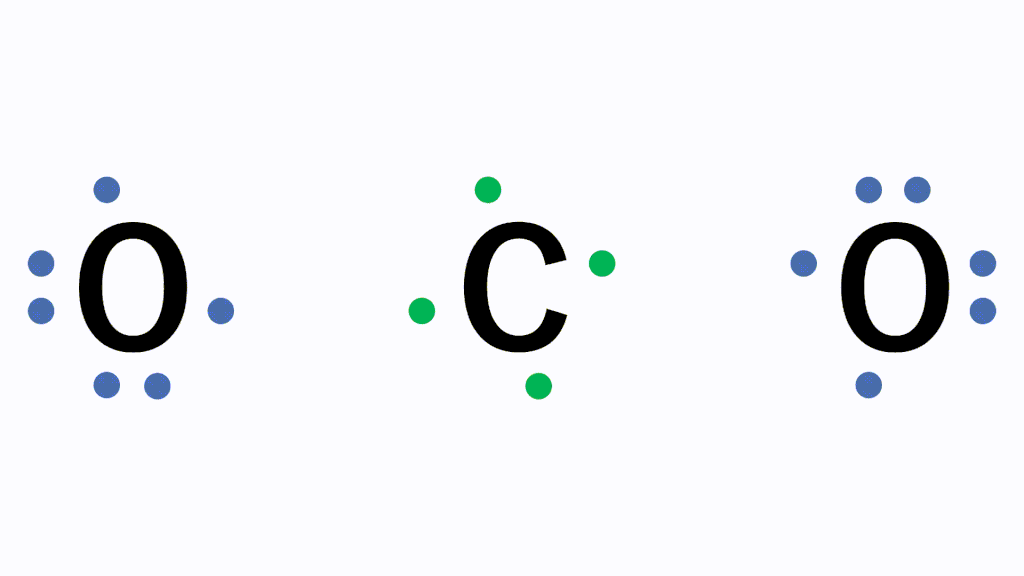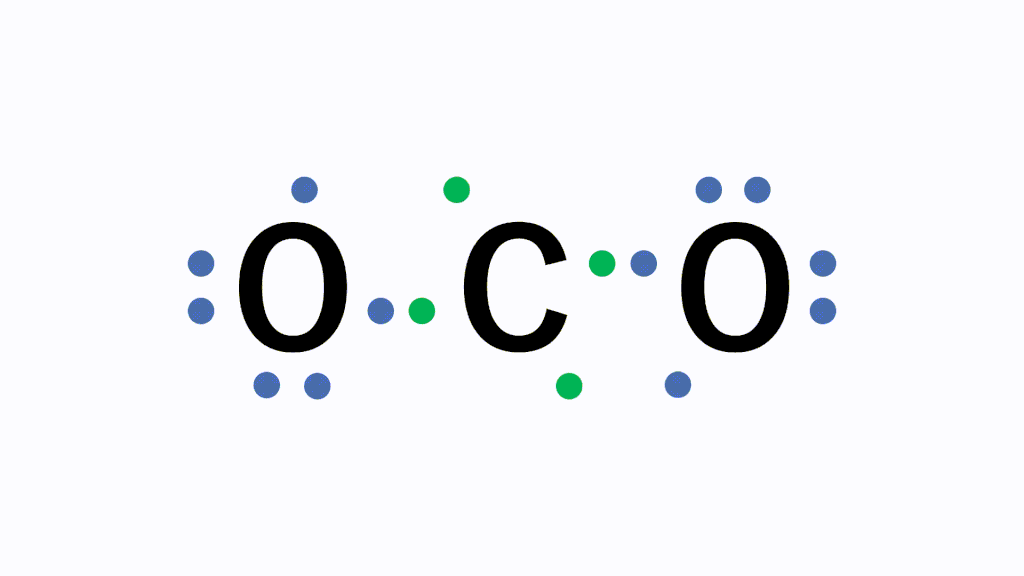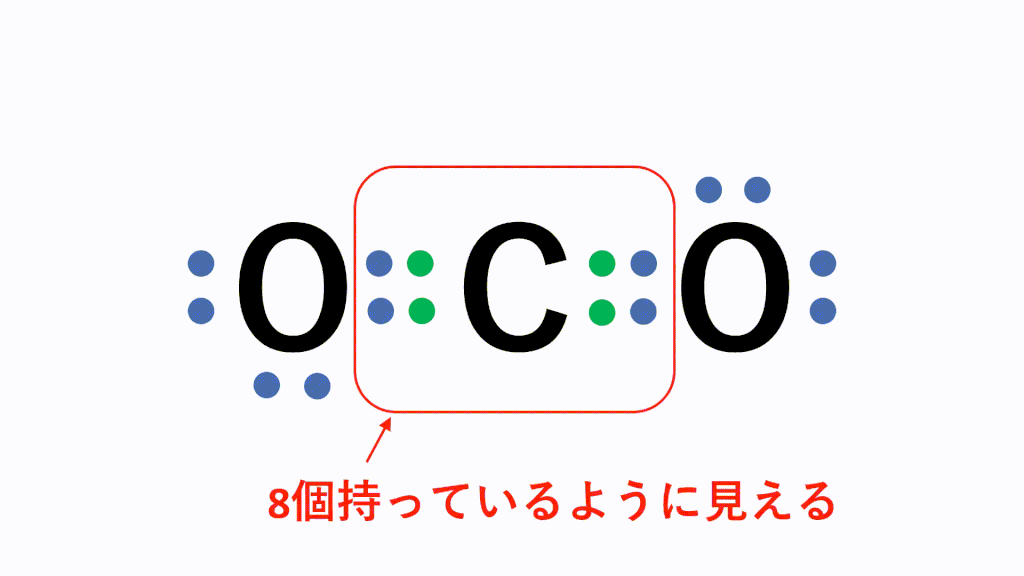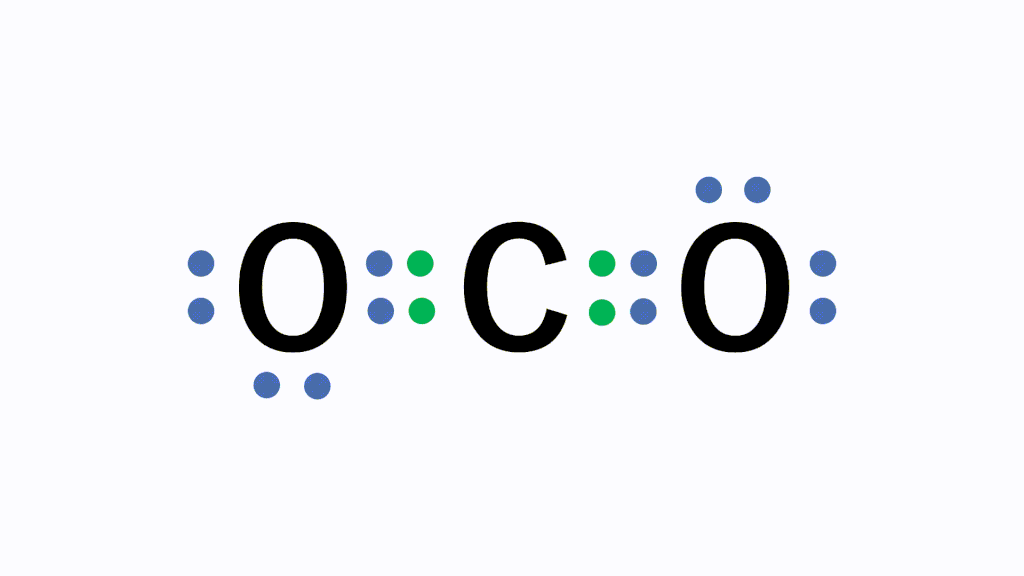
Hは第1周期なので最外殻電子数が2個、Cは8個になっています。
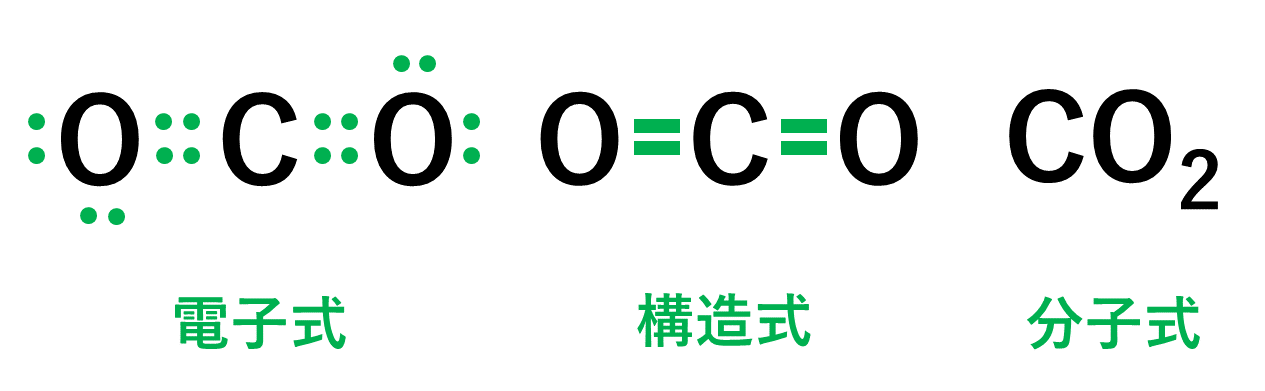
このように、分子の構造というのは、でたらめに原子が共有結合をしているのではなく、すべての原子の最外殻電子の配置が、オクテットあるいは閉殻という希ガスと同じ電子配置になるように結合しています。
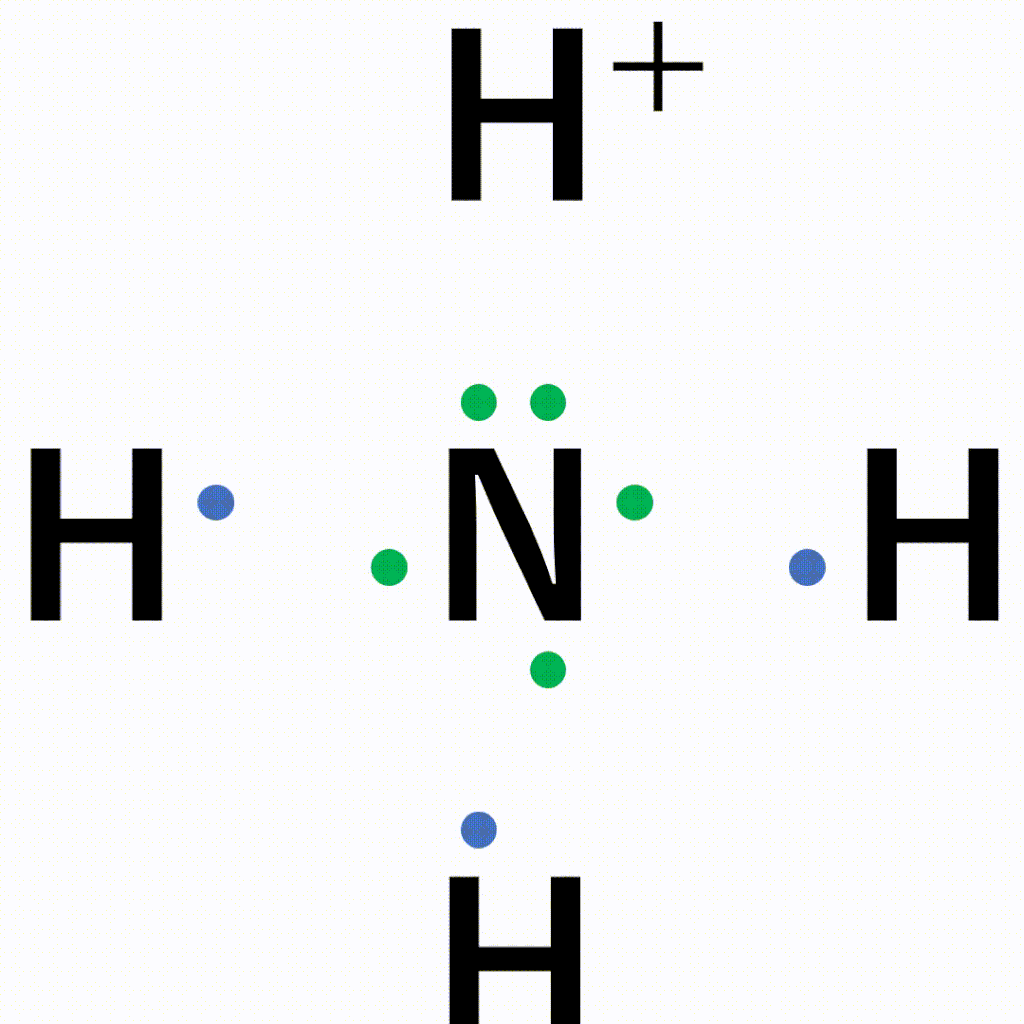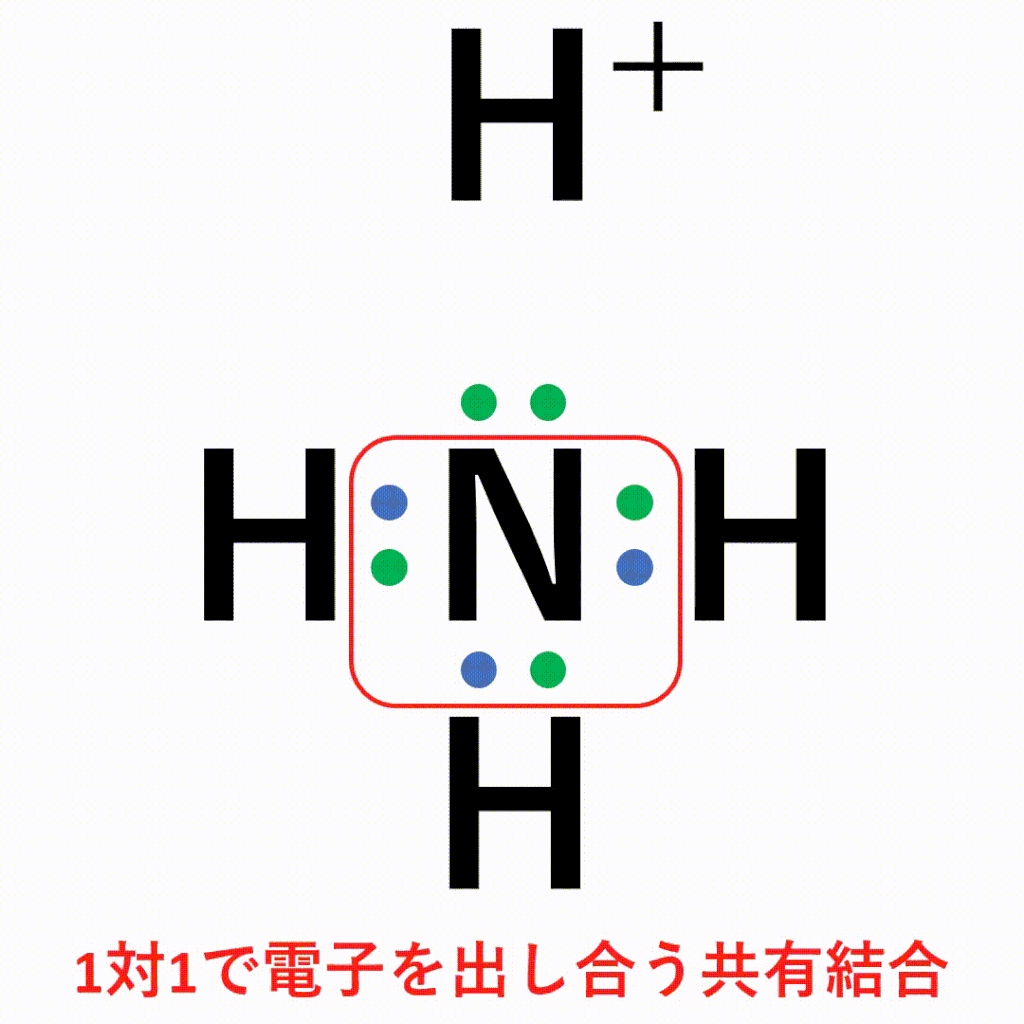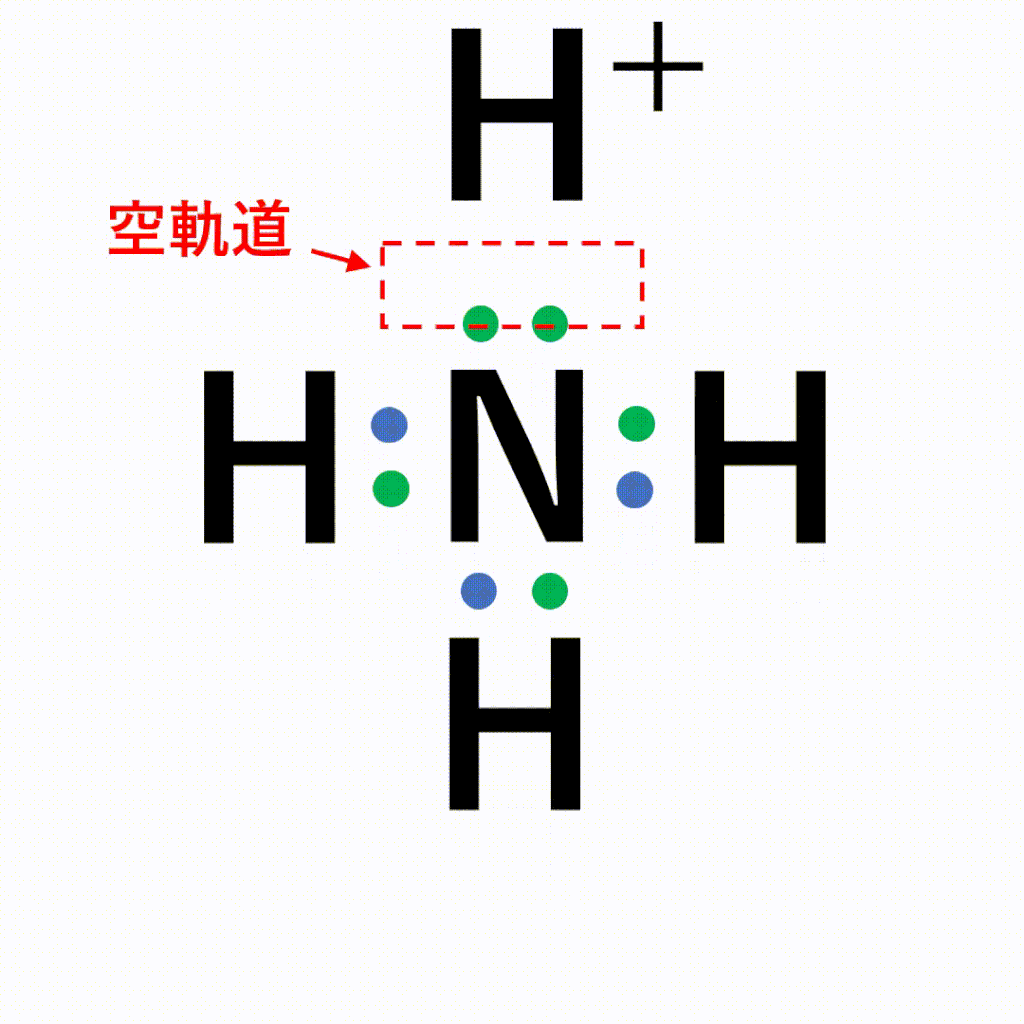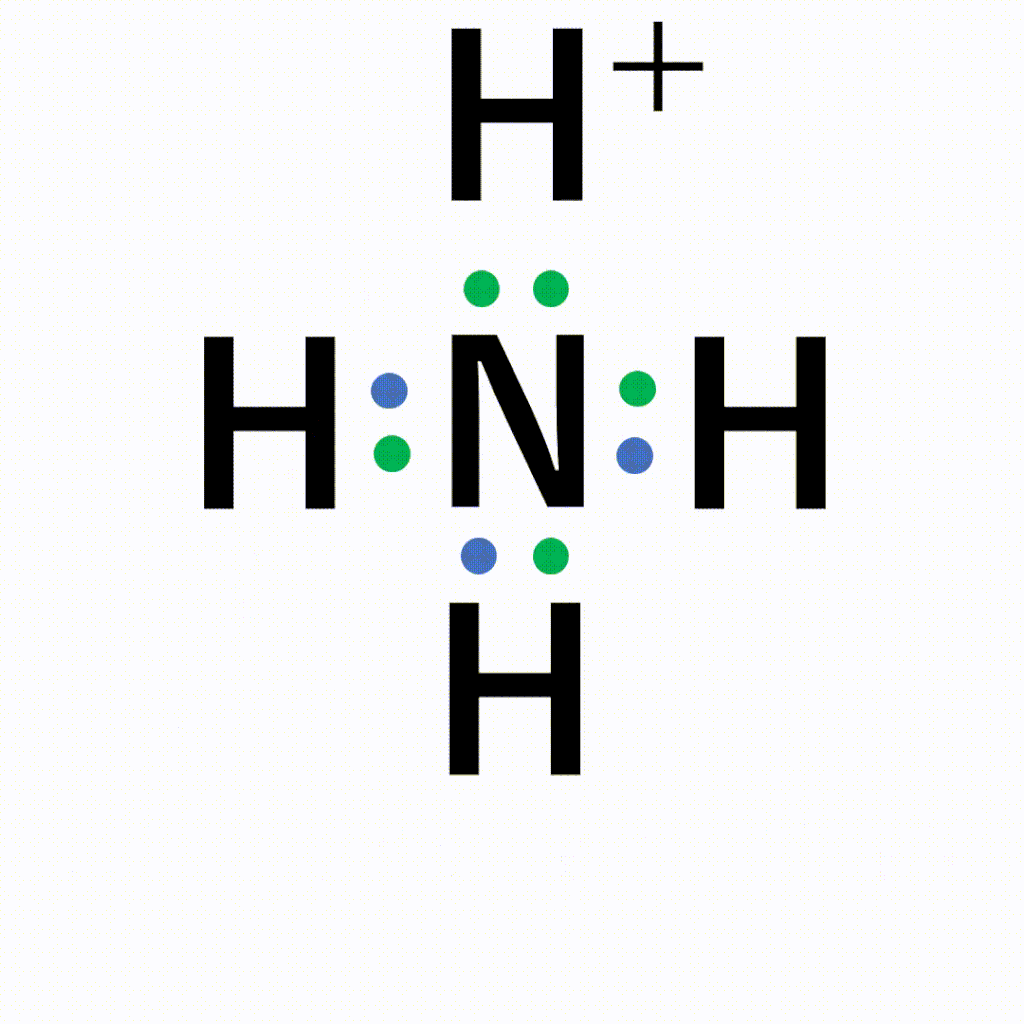
共有結合と配位結合の違い
1:1でお互いに出し合うか、2:0で一方的に出してもらうかの違いです。
詳しくは 配位結合とは?共有結合との違いや矢印の意味、錯イオンの解説 を参照してください。
さいごに
共有結合は有機化学でも必須の知識となりますので、本記事の内容は繰り返し復習しておきましょう。復習はタイミングが命なので、復習タイミングについて知りたい方は、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。