【アニメーションで解説!】共有結合などの結合の基礎知識となる電子式の書き方と一覧を紹介します。また、電子式、構造式、分子式、電子対、不対電子、共有電子対、非共有電子対の意味と違いについても解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
電子式とは
電子式 … 元素記号の周囲に,最外殻電子を点・で表した式
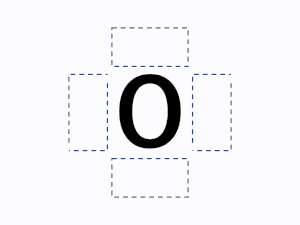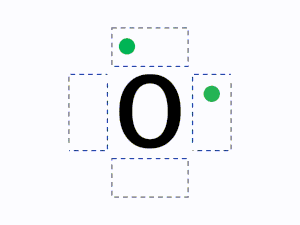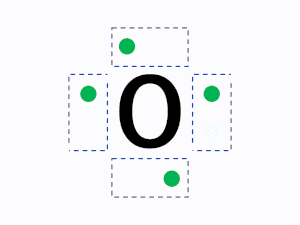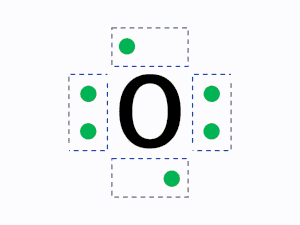
例えば、以下の酸素であれば、原子番号が8番なので電子は8個あり、K殻に2個存在するため、最外殻のL殻には6個の電子が存在します。この6個の電子を点・で表し、元素記号の周囲に配置します。

それでは具体的に書き方を解説していきます。
電子式の書き方
元素記号の周りに最外殻電子を4方向にできるだけ対を作らず配置して書きます。
元素記号の周り(上下左右)に4つの見えない箱があると想像し、1つの箱に電子が最大2つまで入ると考えます。
ルール1の通り1つの箱には最大で2つの電子を入れることができるが、2つ目の電子を入れるときはすべての箱に電子を1つずつ入れた後に入れていく。
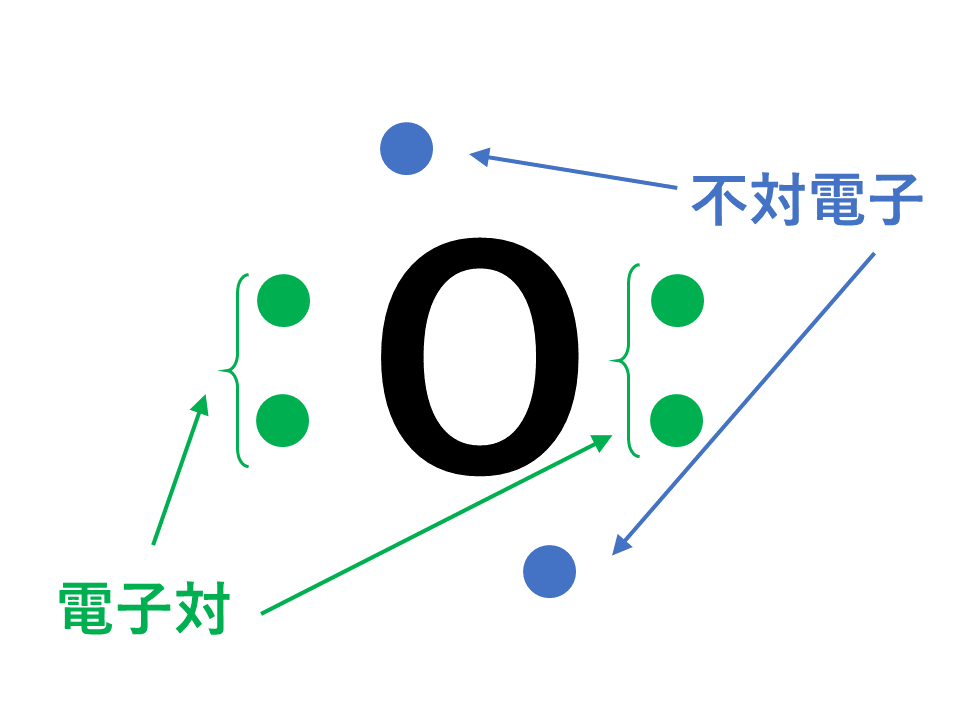
電子対と不対電子
原子中の価電子は,2個で対になったとき安定になります。このように2個の価電子が対になったものを電子対,対にならずに単独で存在する価電子を不対電子といいます。
共有電子対と非共有電子対
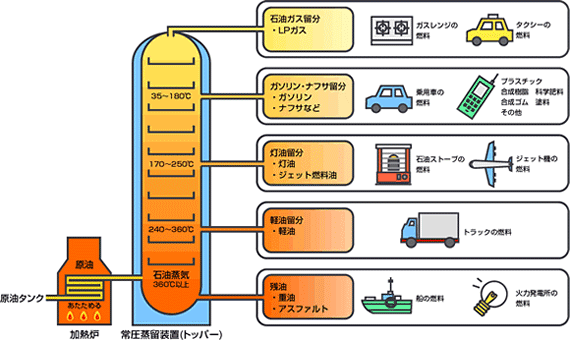
例えば、フッ素Fは最外殻電子が7個あり、電子対が3組と不対電子が1つという状況です。
このとき各原子が不対電子を1個ずつ出し合って共有すると、共有結合という結合になり、フッ素分子F2となります。
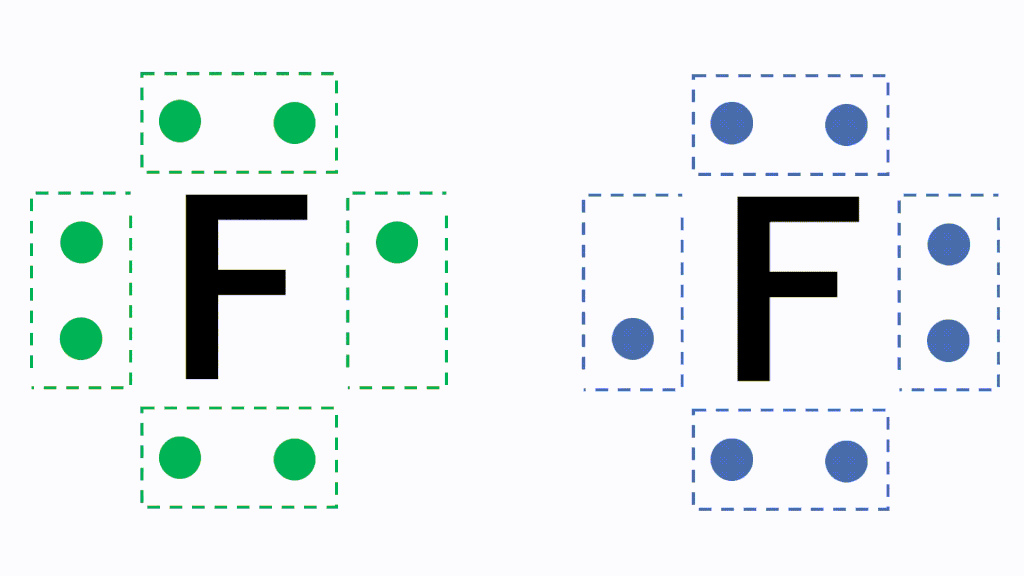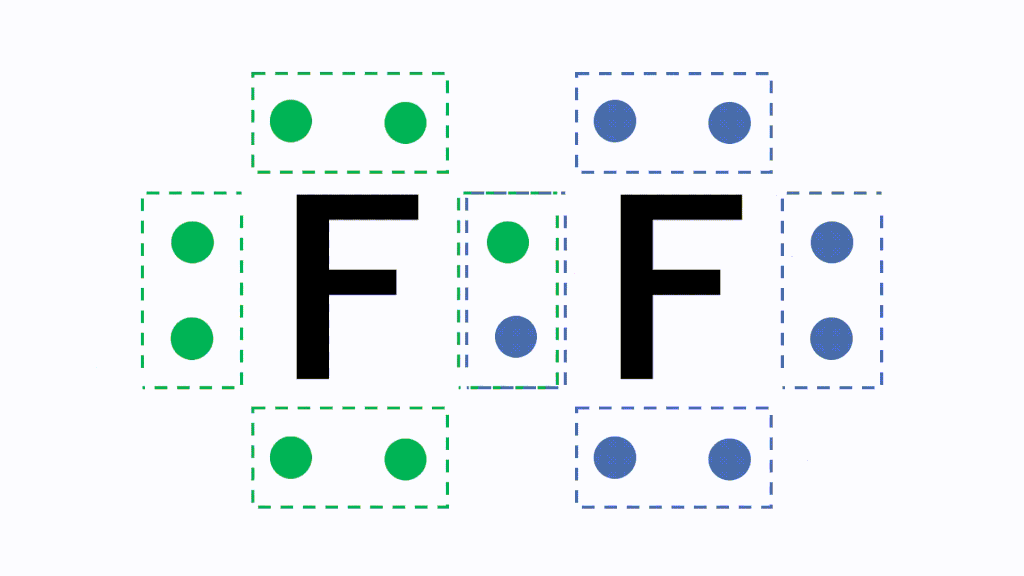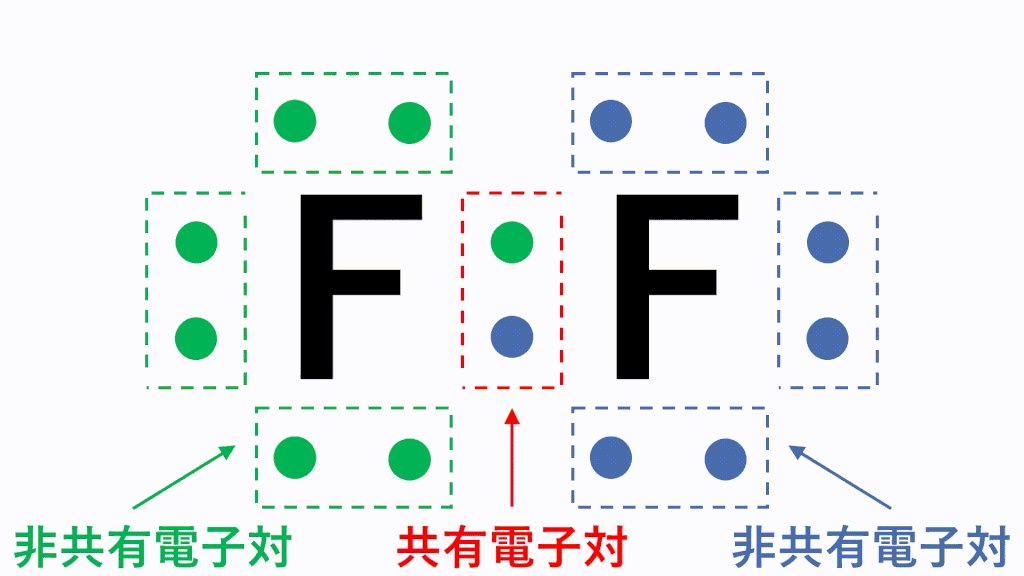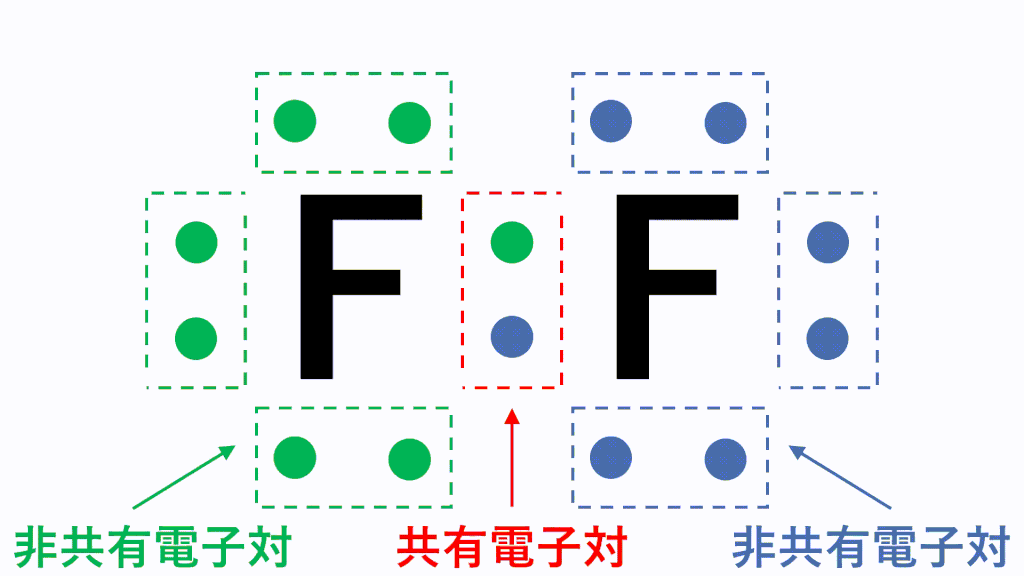
分子の電子式に含まれる電子対のうち、2つの原子が電子を1コずつ出し合うことで形成される電子対を共有電子対、1つの原子が持つ電子のみで形成される電子対を非共有電子対といいます。
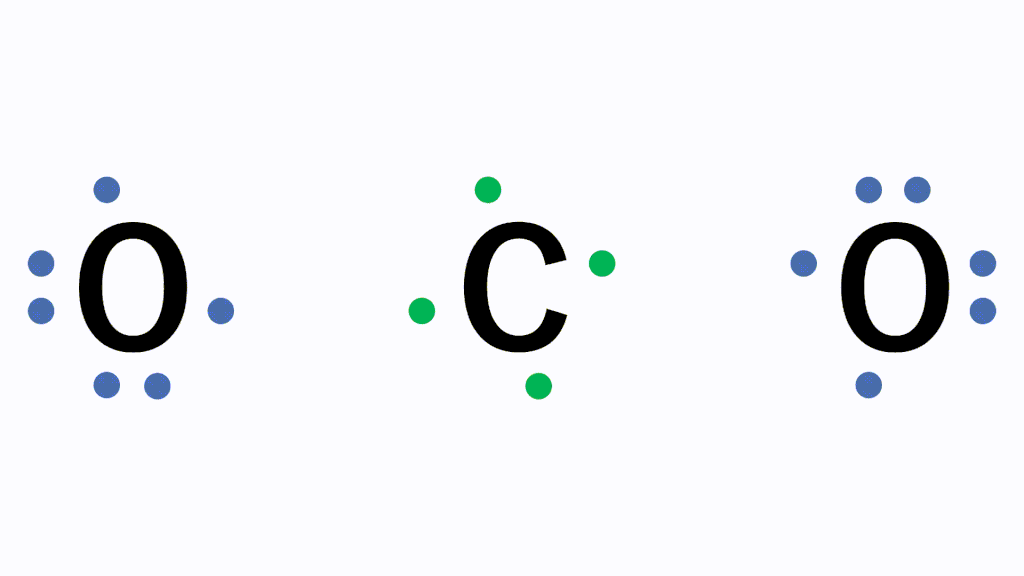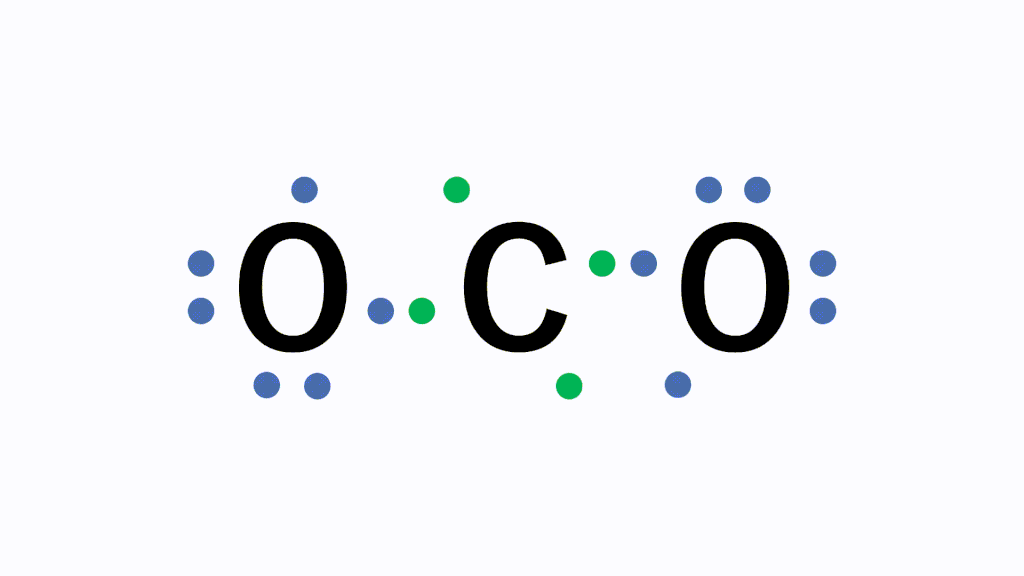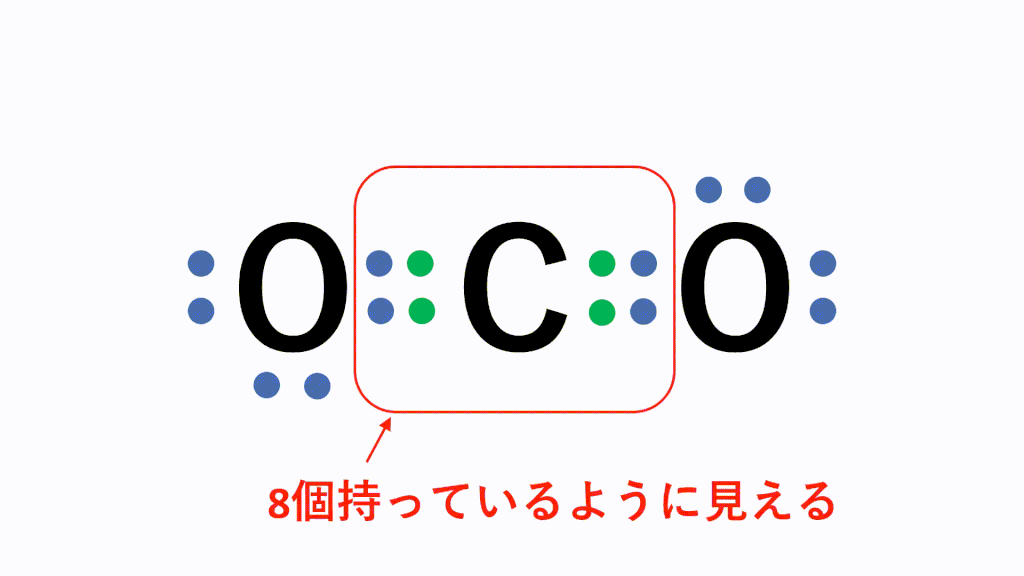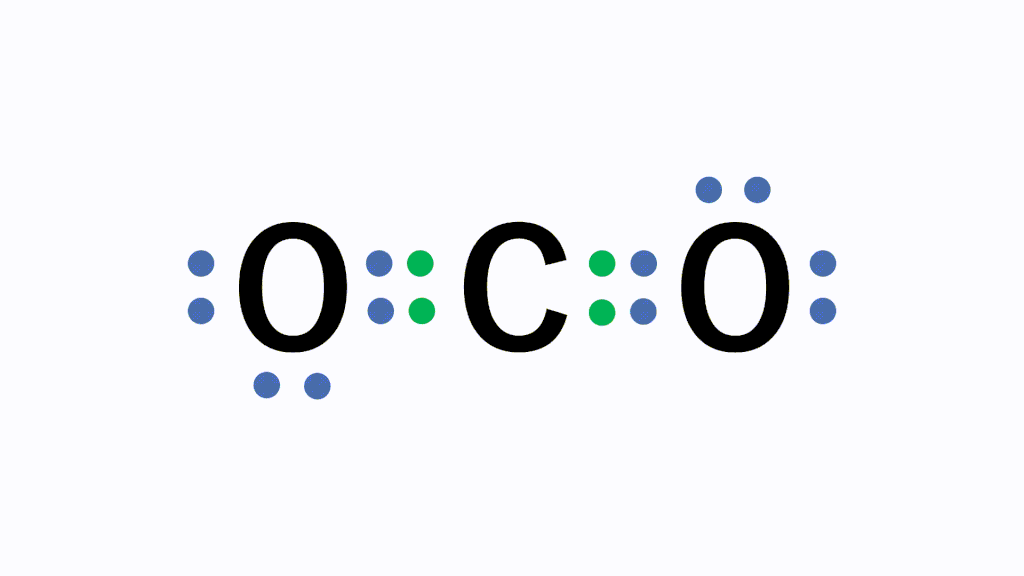
なぜこのように不対電子を出し合う必要があるかというと、原子のままだと最外殻電子が7個で不安定だからです。あと電子が1個あればネオンNeと同じ電子配置のオクテットとなり安定的になります。そのため、フッ素原子同士で不対電子を出し合い共有します。

すると、どちらの原子にとっても8個ずつ持っている状態に見えますので、安定的に存在することができます。これが共有結合です。
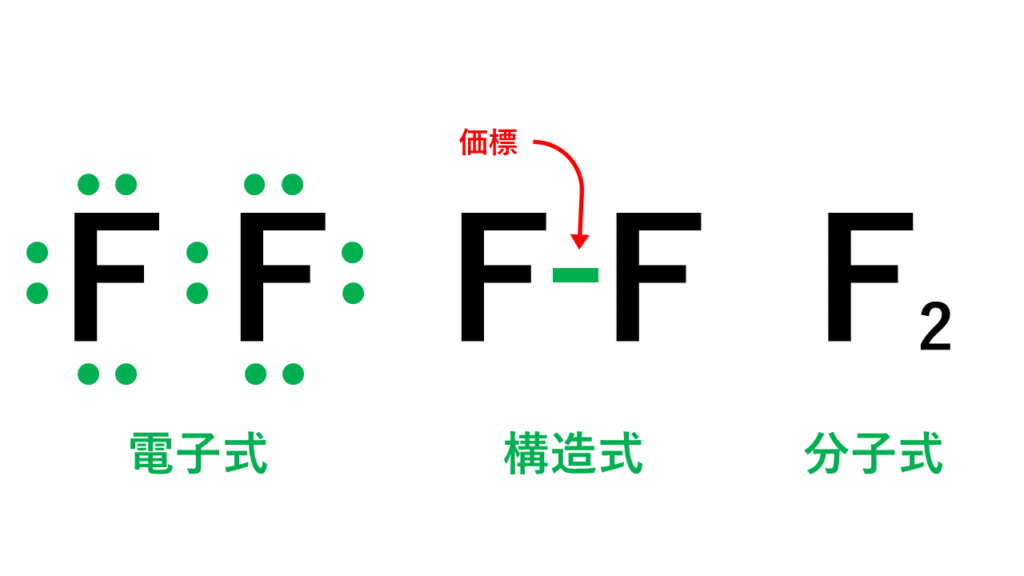
電子式と構造式と分子式の違い
電子式のうち、1組の共有電子対を線分で表したものを構造式といいます。
このとき、線分のことを価標といい、非共有電子対は省略するのが構造式を書く際のルールです。
分子を構成する原子の数を表しただけのものが分子式です。
原子の電子式一覧
原子番号1〜18の原子の電子式を一覧にまとめておきます。
| 元素 | 原子番号 | 最外殻電子数 | 電子式 |
| 水素 | 1 | 1 |  |
| ヘリウム | 2 | 2 |  |
| リチウム | 3 | 1 |  |
| ベリリウム | 4 | 2 |  |
| ホウ素 | 5 | 3 |  |
| 炭素 | 6 | 4 |  |
| 窒素 | 7 | 5 |  |
| 酸素 | 8 | 6 |  |
| フッ素 | 9 | 7 |  |
| ネオン | 10 | 8 |  |
| ナトリウム | 11 | 1 |  |
| マグネシウム | 12 | 2 | 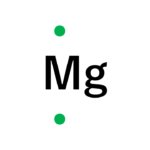 |
| アルミニウム | 13 | 3 |  |
| ケイ素 | 14 | 4 |  |
| リン | 15 | 5 |  |
| 硫黄 | 16 | 6 |  |
| 塩素 | 17 | 7 |  |
| アルゴン | 18 | 8 |  |
さいごに
電子式は、あくまで本来複雑な化学結合を高校レベルに落とし込んで理解できるように考えられたモデルなので、深みにハマりすぎないよう注意してください。たとえば一酸化窒素の電子式とか正直どうでもいいです。基本的な書き方といくつかの具体例の書き方が理解できていれば問題ありません。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。今回のように、どこまで覚える必要があるのか、自分で判断が難しいと感じたときは、塾や予備校などに頼ってみるのも手かもしれません。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。