「弱酸の塩に強酸を加えた場合、弱酸が遊離する」や「弱塩基の塩に強塩基を加えると、弱塩基が遊離する」というのは、どういう仕組みなのでしょうか。本記事では、無機化学や有機化学でも頻出な「弱酸遊離」「弱塩基遊離」について、具体例を交えながら解説していきます。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
「弱酸の塩に強酸を加えると弱酸が遊離する」とは?
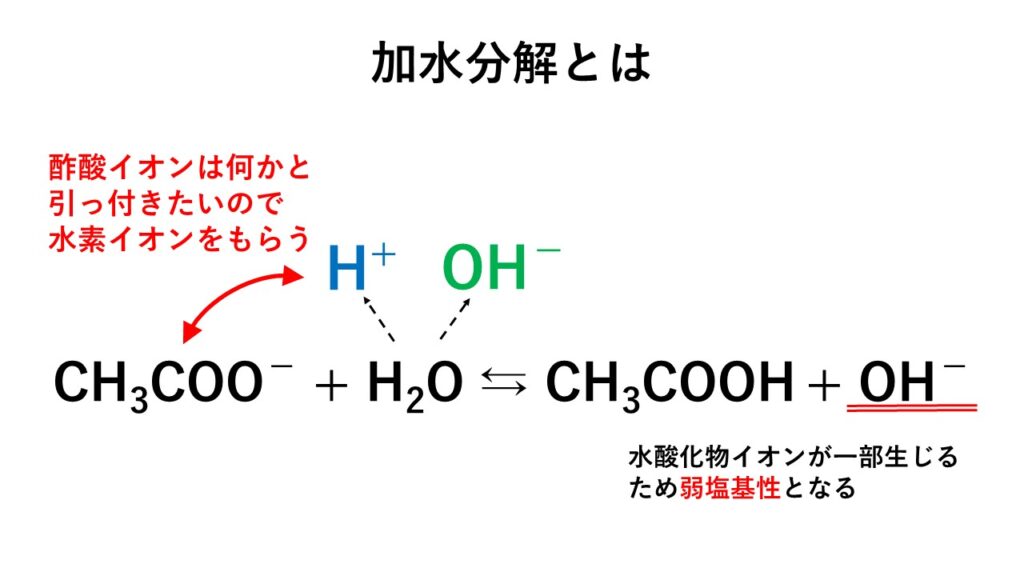
本記事を読む前に、「加水分解」のことを理解できていますか?不安な人は先に以下で確認してください。
塩の加水分解を忘れた人は【図解】塩の加水分解と塩の種類と分類・液性を解説を参考にしてください。
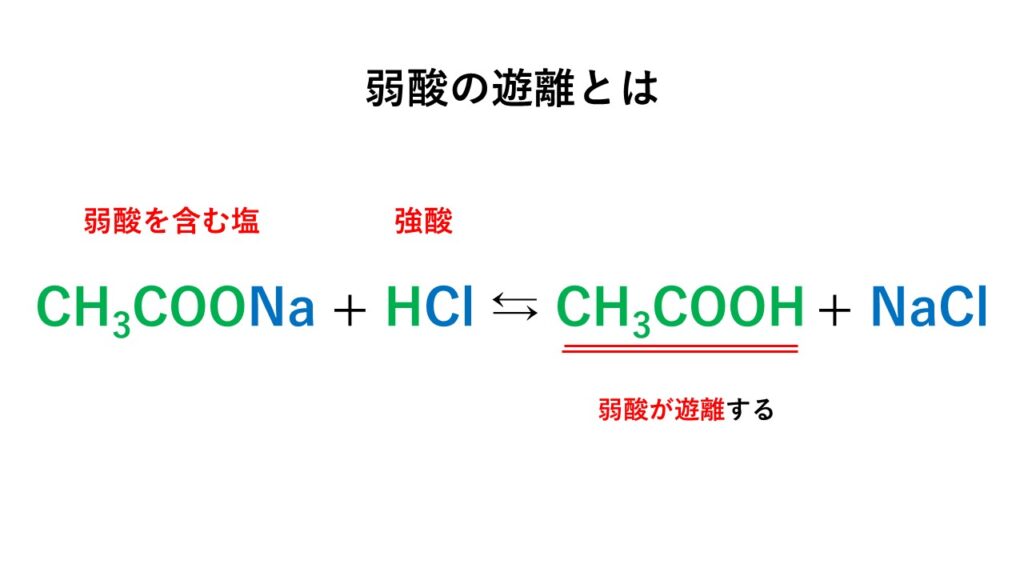
具体例として、代表的な酢酸ナトリウムに塩酸を加えた場合について考えてみましょう。
実際に起こる反応は以下です。
CH3COONa + HCl → CH3COOH + NaCl
ちなみに以下の反応はおこりません。
CH3COOH + NaCl → CH3COONa + HCl
何が違うのでしょうか。
まず、「酢酸ナトリウム」について考えてみましょう。
酢酸ナトリウムCH3COONaというのは、
酢酸CH3COOHという弱酸と水酸化ナトリウムNaOHという強塩基からなる塩です。
そのため、酢酸ナトリウムCH3COONaは、強塩基であるNa+の「くっつきたくない」性質により、いったん完全電離します。
これでナトリウムイオンNa+は安定になりました。
しかし、弱酸である酢酸イオンCH3COO-は、誰かとくっついていたいので、不安定な状態です。
この溶液には、そのほかに強酸の塩酸HClが電離することによって生じた水素イオンH+とCl-が大量にあります。
そのため、不安定な酢酸イオンCH3COO-は大量にある水素イオンH+と反応してくっつき、酢酸CH3COOHになります。その結果、Na+とCl-が余ります。
つまり、反応式でいうと、本当は、
CH3COONa + HCl → CH3COOH + Na+ + Cl-
になっていますが、イオン反応式ではなく、化学反応式として書く必要があるため、
CH3COONa + HCl → CH3COOH + NaCl
と書きます。
それでは逆に、
CH3COOH + NaCl → CH3COONa + HCl
この反応が起こらない理由について考えてみましょう。
まず、酢酸は弱酸の分子の状態としてくっついているので、すでに安定的です。
また、塩化ナトリウムは強塩基のナトリウムイオンNa+も強酸の塩化物イオンCl-もどちらも「強」なので実際にはイオンとして存在していて、上と同じくイオン反応式で書くべきではないためにNaClと書かれています。つまり安定です。
お互いに安定なのでわざわざ反応しませんので、この反応は起こりません。
「弱塩基の塩に強塩基を加えると弱塩基が遊離する」とは?
具体例として、代表的な塩化アンモニウムに水酸化ナトリウムを加えた場合について考えてみましょう。
実際に起こる反応は以下です。
NH4Cl + NaOH → NH3 + NaCl + H2O
まず、「塩化アンモニウム」について考えてみましょう。
塩化アンモニウムNH4Clというのは、
アンモニアNH3という弱塩基と塩酸HClという強酸からなる塩です。
そのため、塩化アンモニウムNH4Clは、強酸であるCl-の「くっつきたくない」性質により、いったん完全電離します。
これで塩化物イオンCl-は安定になりました。
しかし、弱塩基であるアンモニウムイオンNH4+は、誰かとくっついていたいので、不安定な状態です。
この溶液には、そのほかに強塩基の水酸化ナトリウムNaOHが電離することによって生じた水酸化物イオンOH-とNa+が大量にあります。
そのため、不安定なアンモニウムイオンNH4+は大量にある水酸化物イオンOH-と反応してくっつき、NH4+OH-となり、NH3とH2Oになります。その結果、Na+とCl-が余ります。
つまり、反応式でいうと、本当は、
NH4Cl + NaOH → NH3 + H2O + Na+ + Cl-
になっていますが、イオン反応式ではなく、化学反応式として書く必要があるため、
NH4Cl + NaOH → NH3 + H2O +NaCl
さいごに
弱酸遊離・弱塩基遊離は、無機化学、有機化学を学ぶうえで基礎知識として必要となる話です。理解できたら上記で説明した具体例くらいは覚えておくようにしましょう。
なお、暗記は復習のタイミングが命です。僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法に復習のタイミングについても記載していますので、参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。