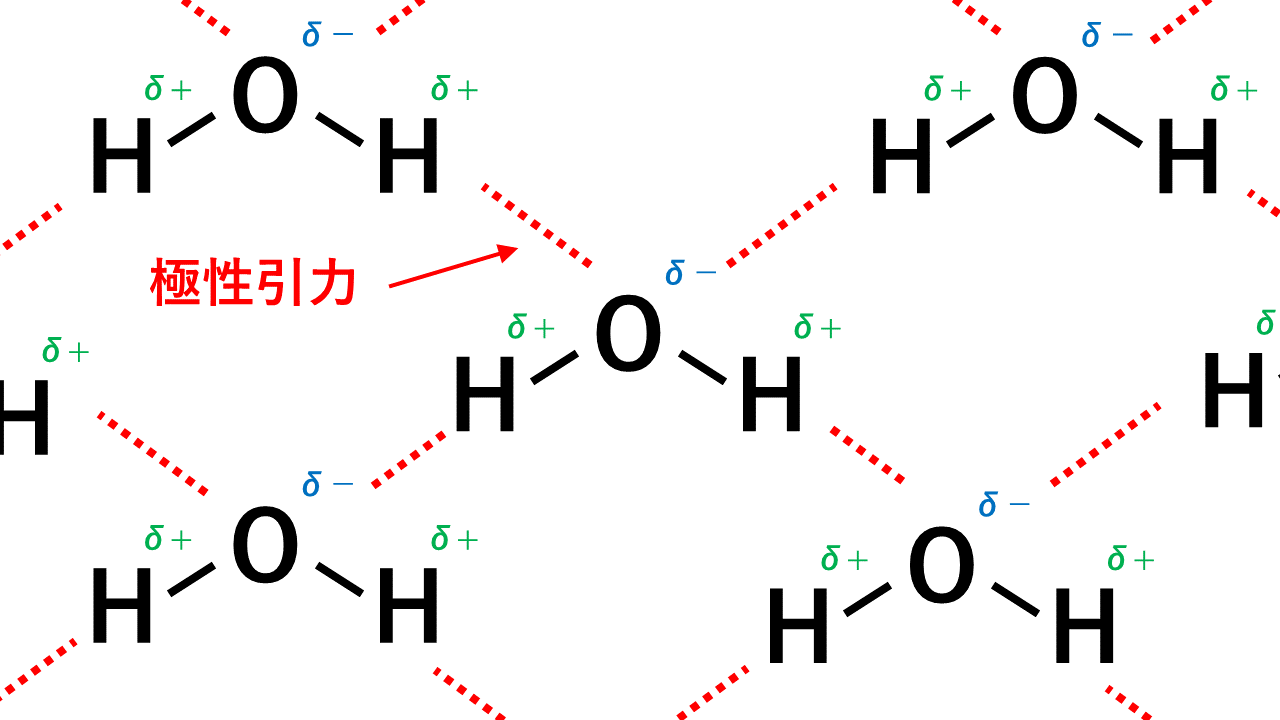
【図解】原子価とは価標(棒線)の本数のことです。この意味について詳しく解説したうえで代表的な原子の原子価の一覧を紹介します。また、紛らわしい価電子との違いについても解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
原子価とは
原子価とは、注目した原子から出ている価標(棒線)の本数のことです。
では、価標とは何だったのか、価電子や不対電子などとの違いについて説明していきます。
価電子数と原子価の違い
価電子とは最外殻に存在する電子の数のことです。
価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。
例:炭素

価電子数が4つなので、すべて不対電子となります。
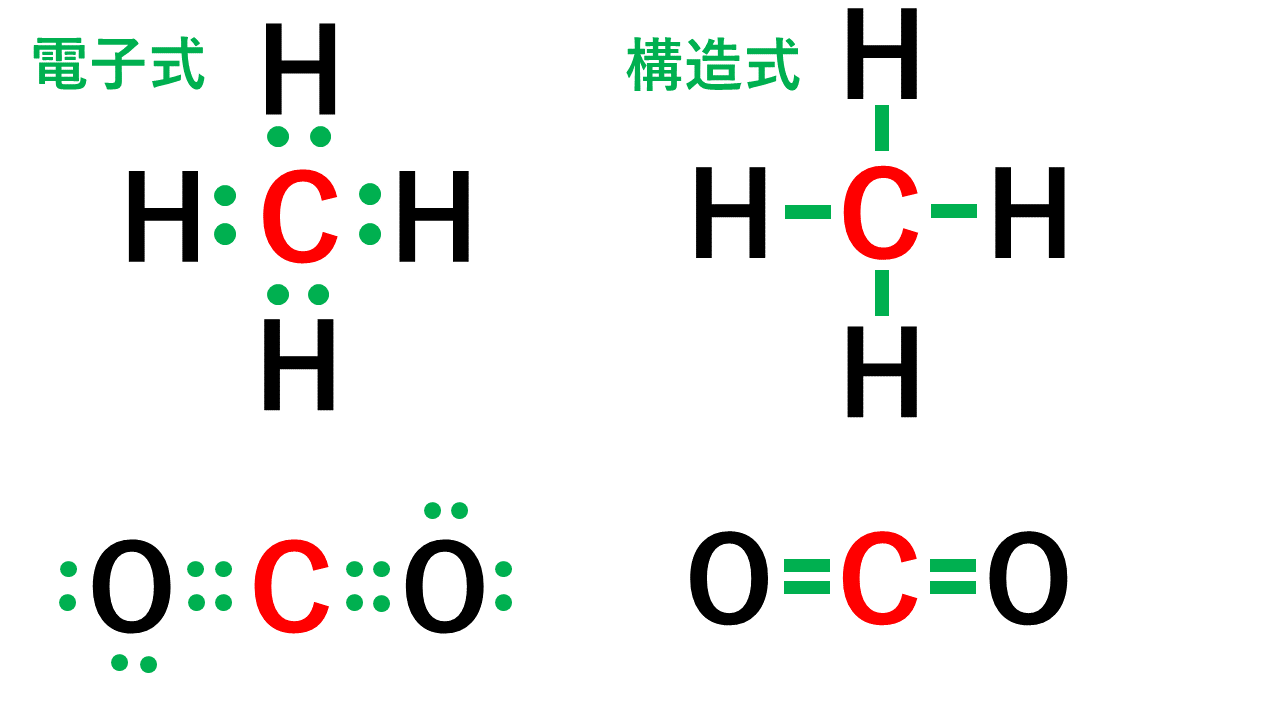
例えば、メタンCH4の場合、不対電子4つと水素が共有結合し、4本の共有結合が生じます。炭素原子Cからは、価標(棒線)が4本出ています。
二酸化炭素CO2の場合、二重結合となりますが、同様に炭素原子Cからは、価標(棒線)が4本出ています。
よって、Cの原子価は4です。(価電子数4と一致します。)
次に、価電子数が5個以上であれば、不対電子以外に非共有電子対が存在するため、価電子数と不対電子の数が一致せず、価電子数と価標の数が一致しません。
例:窒素

価電子数5つのうち、3つが不対電子となります。
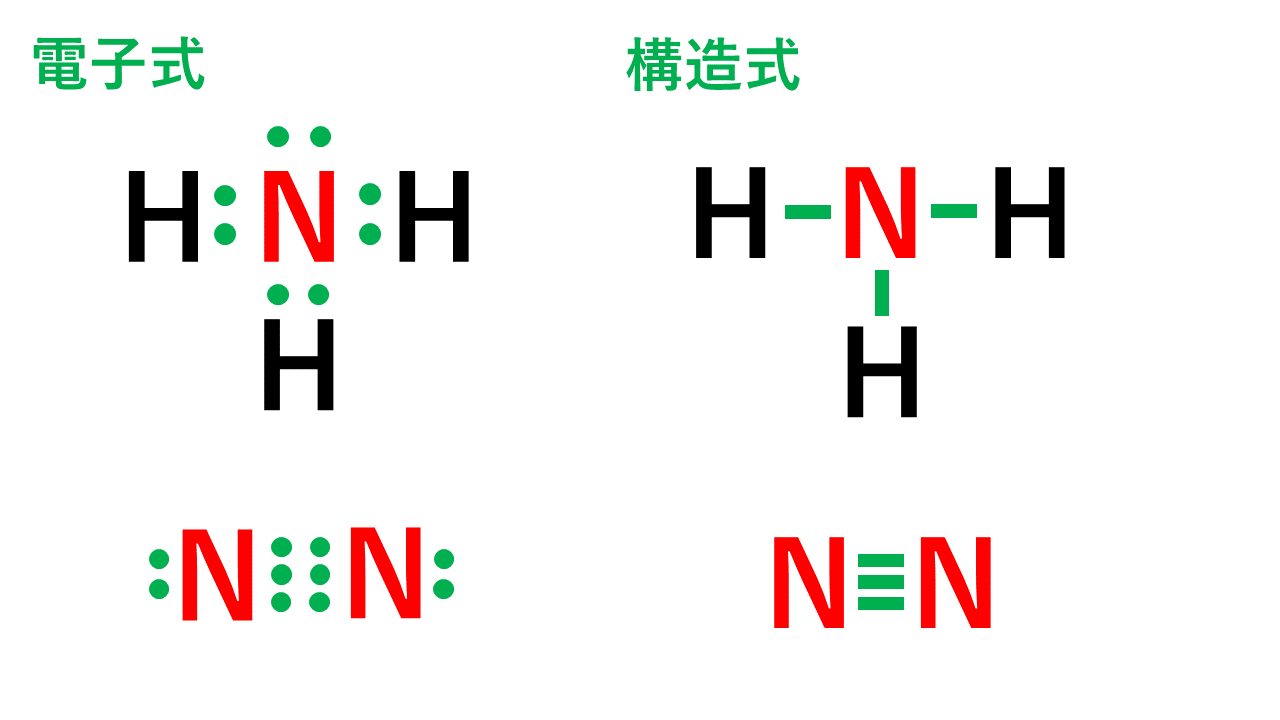
例えば、アンモニアNH3の場合、不対電子3つと水素が共有結合し、3本の共有結合が生じます。窒素原子Nからは、価標(棒線)が3本出ています。
窒素分子N2の場合、三重結合となりますが、同様に窒素原子Nからは、価標(棒線)が3本出ています。
よって、Nの原子価は3です。(価電子数5と一致しません。)
入試で覚えておくべき原子価の一覧
この原子価という考え方は、有機化学分野の構造式を考える際に有効なので、有機化学でよく出る原子の原子価を一覧で紹介します。
| 水素H | 1 |
|---|---|
| 炭素C | 4 |
| 窒素N | 3 |
| 酸素O | 2 |
| フッ素F | 1 |
| 硫黄S | 2 |
| 塩素Cl | 1 |
| 臭素Br | 1 |
| ヨウ素I | 1 |
以上を見てわかりますか?
原子価、つまり価標の本数というのは、原子状態での不対電子の数と一致するということです。
さいごに
本記事は、原子価という用語の説明でして、言葉自体は出題頻度は極めて低いですが、内容自体は有機化学でも絶対に理解しておかなければならないところで重要です。「入試で覚えておくべき原子価」の項目くらいはスラスラこたえられるように、繰り返し復習することをおすすめします。よければお気に入りに保存するなどして繰り返し見てください。
なお、復習はタイミングが命なのですが、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法に復習のタイミングについても記載しているので、参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。