金属は自由電子で結びついていますが、そもそもどのような仕組みで、この金属結合が成り立っているのかをわかりやすく解説します。また、金属結晶の性質である展性・延性・電気伝導性・金属光沢、金属結合の強さと融点について解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
金属結合の仕組み
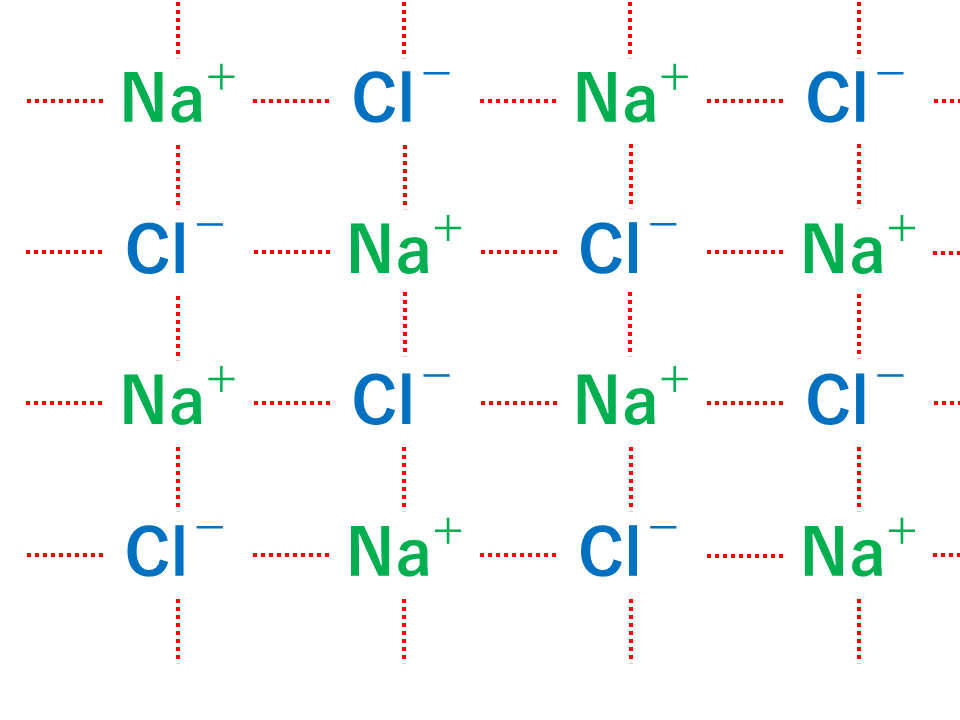
金属結合は金属元素と金属元素が結合するときに生じます。
金属は電気陰性度が低いため、自分が持つ電子を外に出して陽イオンになろうとします。(詳しくは 電気陰性度の定義と周期表での大小関係の解説 を参照してください。)
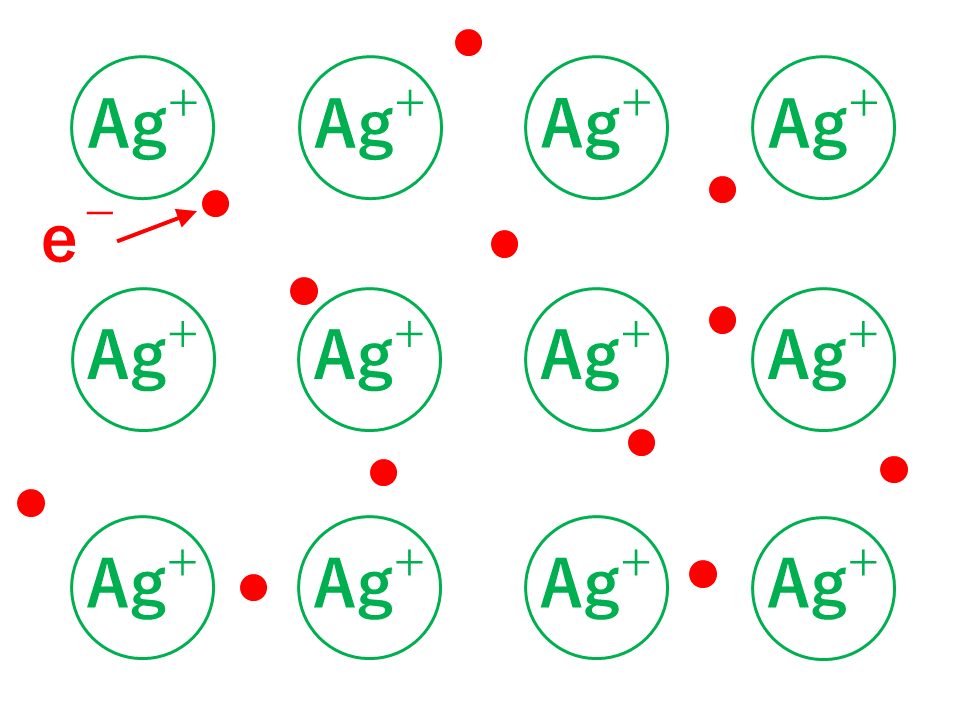
しかし、同じ種類の金属原子同士ではどちらかが電子をもらうという現象は起こりません。そのため、原子核の束縛から解放された電子は、特定の金属原子に固定されることなく、金属全体を動き回ることが出来ます。このような電子を自由電子といいます。つまり、自由電子は,正の電荷をおびた金属原子のまわりを動き回ることによって、ばらばらになろうとする多数の金属原子を電子とのクーロン力を介して結ぶつける働きをしているということです。これが金属結合です。
また、金属結合によってできた物質を金属結晶といいます。金属結合はイオン結合と同様に原子がある限り際限なく結合しつづけます。したがって、分子のようにひとかたまりにならないため、金属の単体は、Al(アルミニウム)、Ag(銀)、Na(ナトリウム)などのように組成式で表します。
金属の電気伝導性
陽イオンを結び付けている自由電子は、その名の通り自由に動く事ができます。そのため、金属に電圧を加えると、自由電子が移動して電流が生じ、電気を通すことができます。この性質を電気伝導性といいます。
金属の展性・延性
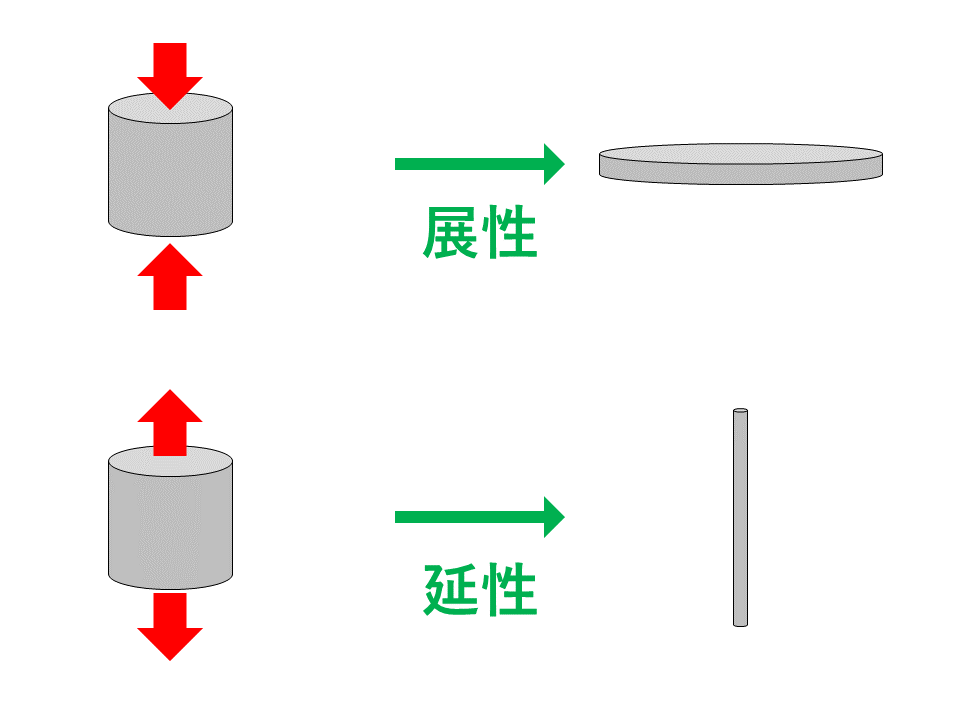
金属は、たたいたり(二次元的)、のばしたり(一次元的)しても、電子が陽イオンの位置に合わせて移動して結合を保とうとします。この性質を展性、延性といいます。
金属光沢

自由電子は光を反射するため、金属は特有の光沢を持ちます。これを金属光沢といいます。
金属結合の強さと融点
よく勘違いしている生徒が多いですが、金属結合は共有結合ほど強くありません。鉄などの金属をイメージして強そうなイメージがあるんだと思いますが、共有結合はダイヤモンドをイメージしてもらえればわかる通り、もっと強い結合です。
また、1原子あたりの自由電子の数が多いほど金属結合は強くなります。そして、強い結合であるほど、切断して液体にするためには多くのエネルギーを必要とするため、融点が高くなる傾向があります。
典型元素-多様(アルカリ金属,Hgなど)※水銀は常温で液体です
遷移元素-かなり高い(鉄や金などを思い浮かべれば理解できると思います)
さいごに
結局のところ、金属は、展性・延性・電気伝導性の3つが重要事項ですので、最低限この3つだけは覚えておいてください。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。