気体反応の法則とは、「気体どうしの反応では,反応に関する気体の体積の間には,同温・同圧のもとでは,簡単な整数比が成り立つ。」というものです。本記事では、気体反応の法則を具体例を踏まえてわかりやすく解説します。発見者ゲーリュサックもセットで覚えましょう。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
気体反応の法則とは
気体反応の法則とは、「気体どうしの反応では,反応に関する気体の体積の間には,同温・同圧のもとでは,簡単な整数比が成り立つ。」というものです。
【例1】
例えば、水素と酸素が反応して水蒸気を生じるとき,水素、酸素、水蒸気の3つの気体の間には次のような物質量の比が成り立ちます。
![気体反応の法則の説明(水蒸気)]() 反応した水素と酸素および生成した水蒸気の物質量の比は係数の比と等しく、2:1:2であり、同温・同圧のもとでは体積比も2:1:2となります。
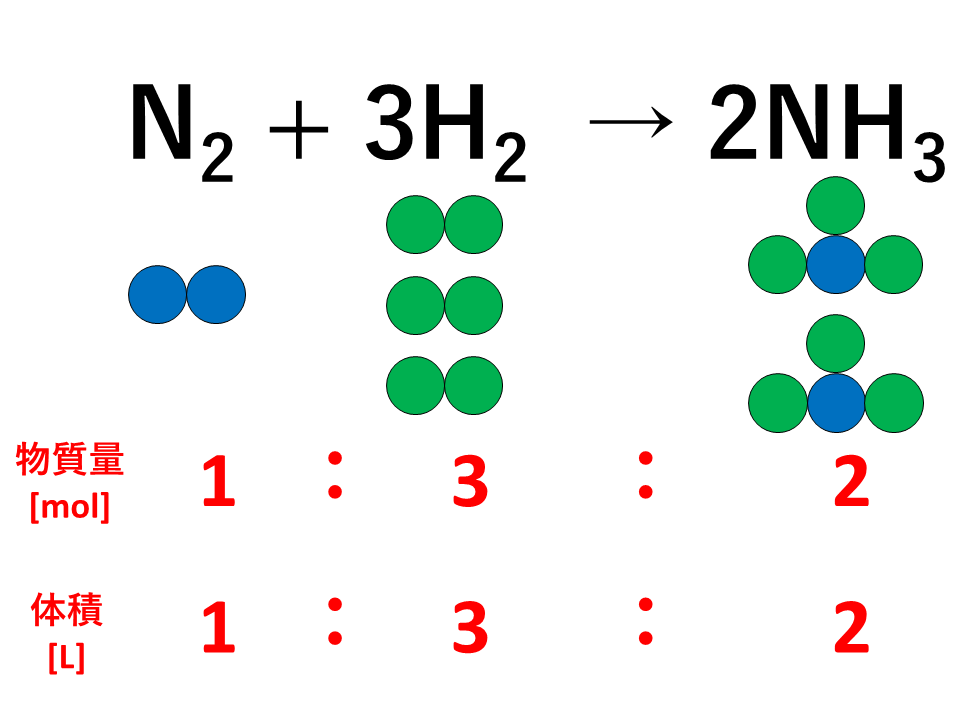
【例2】
例えば、窒素と水素が反応してアンモニアを生じるとき,窒素、水素、アンモニアの3つの気体の間には次のような物質量の比が成り立ちます。
反応した水素と酸素および生成した水蒸気の物質量の比は係数の比と等しく、2:1:2であり、同温・同圧のもとでは体積比も2:1:2となります。
【例2】
例えば、窒素と水素が反応してアンモニアを生じるとき,窒素、水素、アンモニアの3つの気体の間には次のような物質量の比が成り立ちます。
![気体反応の法則の説明(アンモニア)]() 反応した窒素と水素および生成したアンモニアの物質量の比は係数の比と等しく、1:3:2であり、同温・同圧のもとでは体積比も1:3:2となります。
反応した窒素と水素および生成したアンモニアの物質量の比は係数の比と等しく、1:3:2であり、同温・同圧のもとでは体積比も1:3:2となります。
気体反応の法則の発見者ゲーリュサック
![ゲーリュサック]() 出典:https://ja.wikipedia.org/wiki/%E3%82%B8%E3%83%A7%E3%82%BB%E3%83%95%E3%83%BB%E3%83%AB%E3%82%A4%E3%83%BB%E3%82%B2%E3%82%A4%EF%BC%9D%E3%83%AA%E3%83%A5%E3%82%B5%E3%83%83%E3%82%AF
気体反応の法則の発見者はゲーリュサックであり、発見した年は1808年です。
組合せが出題されるので覚えておきましょう。覚え方は以下から。
出典:https://ja.wikipedia.org/wiki/%E3%82%B8%E3%83%A7%E3%82%BB%E3%83%95%E3%83%BB%E3%83%AB%E3%82%A4%E3%83%BB%E3%82%B2%E3%82%A4%EF%BC%9D%E3%83%AA%E3%83%A5%E3%82%B5%E3%83%83%E3%82%AF
気体反応の法則の発見者はゲーリュサックであり、発見した年は1808年です。
組合せが出題されるので覚えておきましょう。覚え方は以下から。
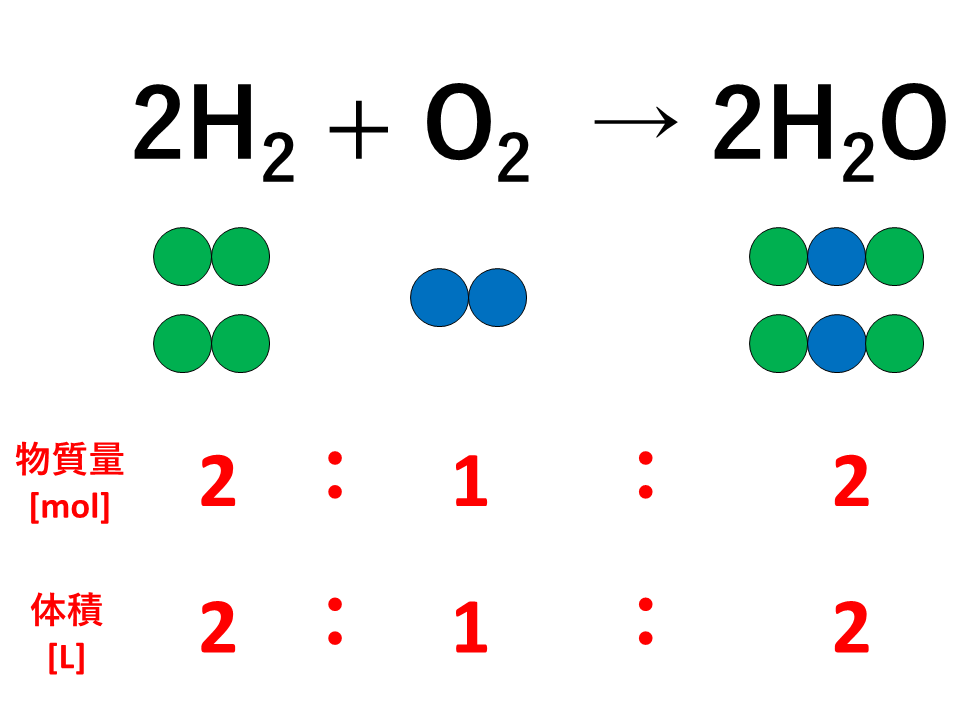 反応した水素と酸素および生成した水蒸気の物質量の比は係数の比と等しく、2:1:2であり、同温・同圧のもとでは体積比も2:1:2となります。
【例2】
例えば、窒素と水素が反応してアンモニアを生じるとき,窒素、水素、アンモニアの3つの気体の間には次のような物質量の比が成り立ちます。
反応した水素と酸素および生成した水蒸気の物質量の比は係数の比と等しく、2:1:2であり、同温・同圧のもとでは体積比も2:1:2となります。
【例2】
例えば、窒素と水素が反応してアンモニアを生じるとき,窒素、水素、アンモニアの3つの気体の間には次のような物質量の比が成り立ちます。
 反応した窒素と水素および生成したアンモニアの物質量の比は係数の比と等しく、1:3:2であり、同温・同圧のもとでは体積比も1:3:2となります。
反応した窒素と水素および生成したアンモニアの物質量の比は係数の比と等しく、1:3:2であり、同温・同圧のもとでは体積比も1:3:2となります。
 出典:https://ja.wikipedia.org/wiki/%E3%82%B8%E3%83%A7%E3%82%BB%E3%83%95%E3%83%BB%E3%83%AB%E3%82%A4%E3%83%BB%E3%82%B2%E3%82%A4%EF%BC%9D%E3%83%AA%E3%83%A5%E3%82%B5%E3%83%83%E3%82%AF
気体反応の法則の発見者はゲーリュサックであり、発見した年は1808年です。
組合せが出題されるので覚えておきましょう。覚え方は以下から。
出典:https://ja.wikipedia.org/wiki/%E3%82%B8%E3%83%A7%E3%82%BB%E3%83%95%E3%83%BB%E3%83%AB%E3%82%A4%E3%83%BB%E3%82%B2%E3%82%A4%EF%BC%9D%E3%83%AA%E3%83%A5%E3%82%B5%E3%83%83%E3%82%AF
気体反応の法則の発見者はゲーリュサックであり、発見した年は1808年です。
組合せが出題されるので覚えておきましょう。覚え方は以下から。


