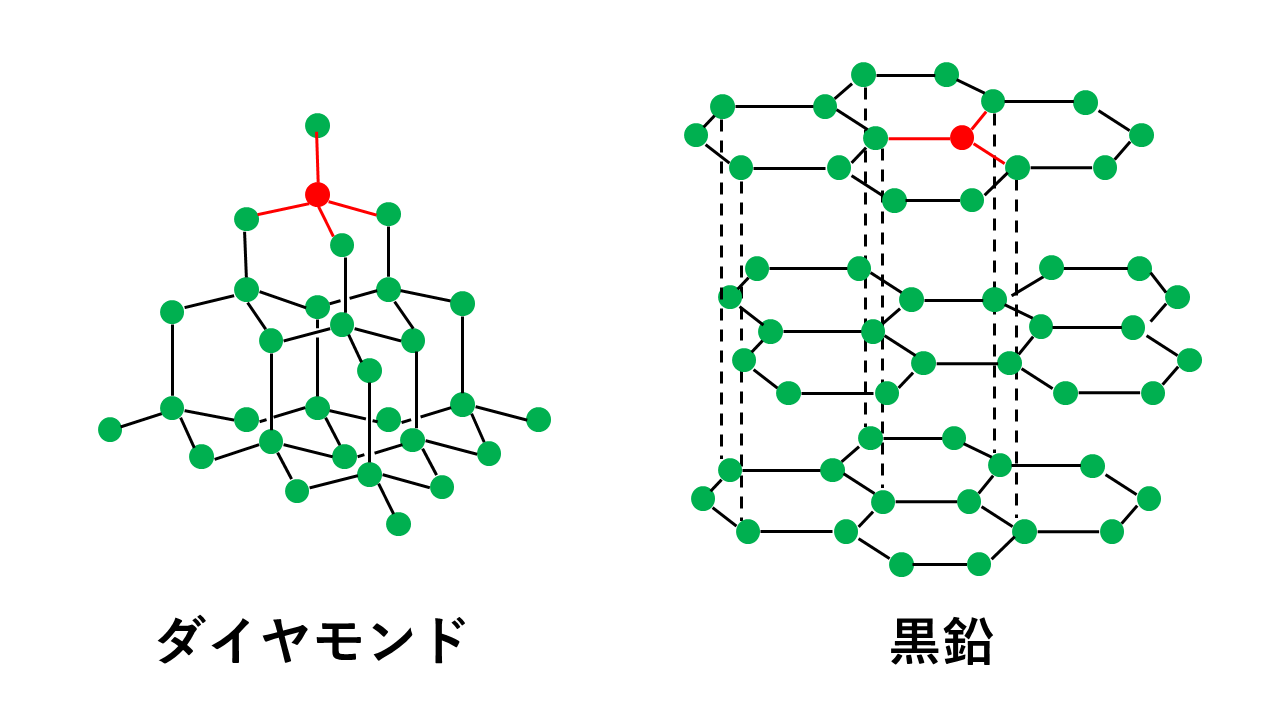
共有結合の結晶(共有結晶)であり同素体であるダイヤモンドと黒鉛は、価電子4つのうち、結合に使われている電子の個数が異なります。その構造の違いから機械的性質、電気伝導性、もちろん見た目から性質が全く異なります。図を使いながらできるだけ詳しく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
C(炭素)の同素体かつ共有結合の結晶(共有結晶)
ダイヤモンドも黒鉛もともにC(炭素)の同素体であり、どちらも共有結合が際限なく結合し続けて形成された共有結合の結晶(共有結晶)です。
※同素体を忘れた人は同素体と同位体の違いと例(硫黄・炭素・酸素・リン)を参照してください。
※共有結合の仕組みを忘れた人は共有結合とは?二酸化炭素などの例を図でわかりやすく解説を参照してください。
ダイヤモンドと黒鉛の構造
同素体であるダイヤモンドと黒鉛は構造が異なります。
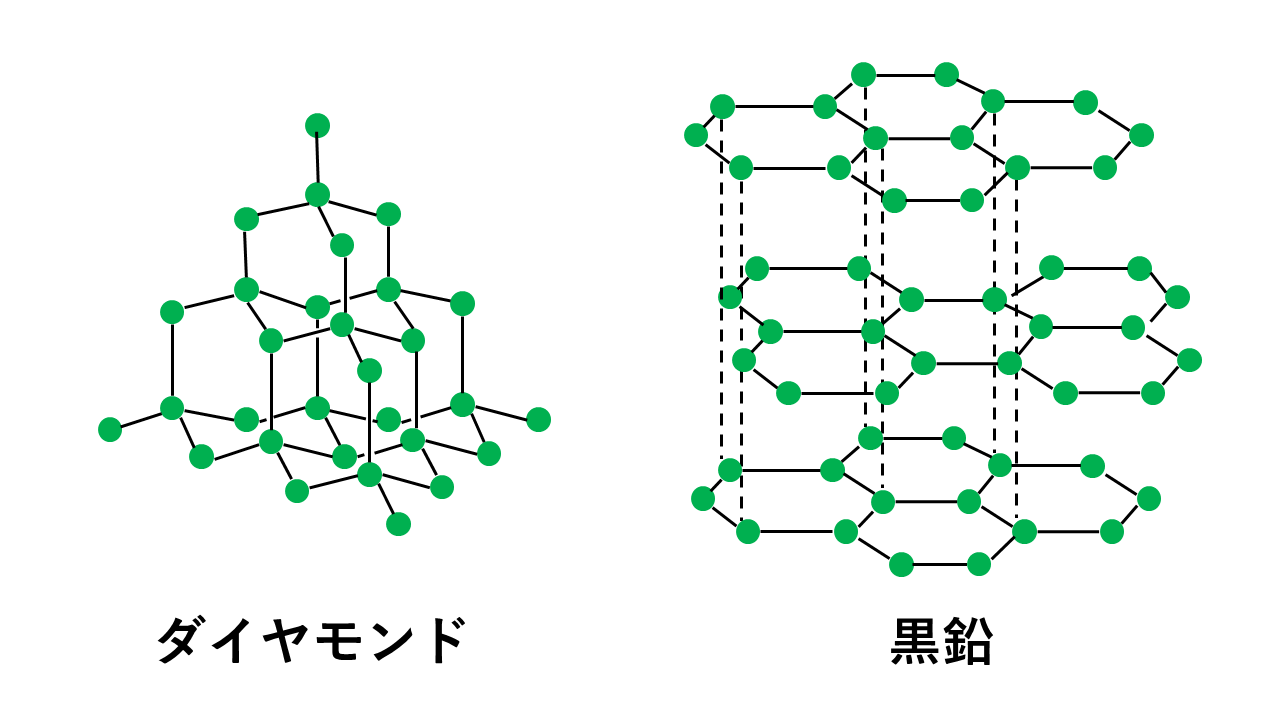
それではなぜこのような違いが生じるのでしょうか。
炭素Cは原子番号が6番なのでK殻に2個の電子が入り、L殻(最外殻)に4個の電子をもっています。

そして原子状態では4個の電子すべてが不対電子なので普通に考えると、以下の図のように隣り合う炭素原子と4本の共有結合をするはずです。

この点がダイヤモンドと黒鉛では違います。
ダイヤモンドの場合、炭素Cの価電子4個をすべて結合に使います。
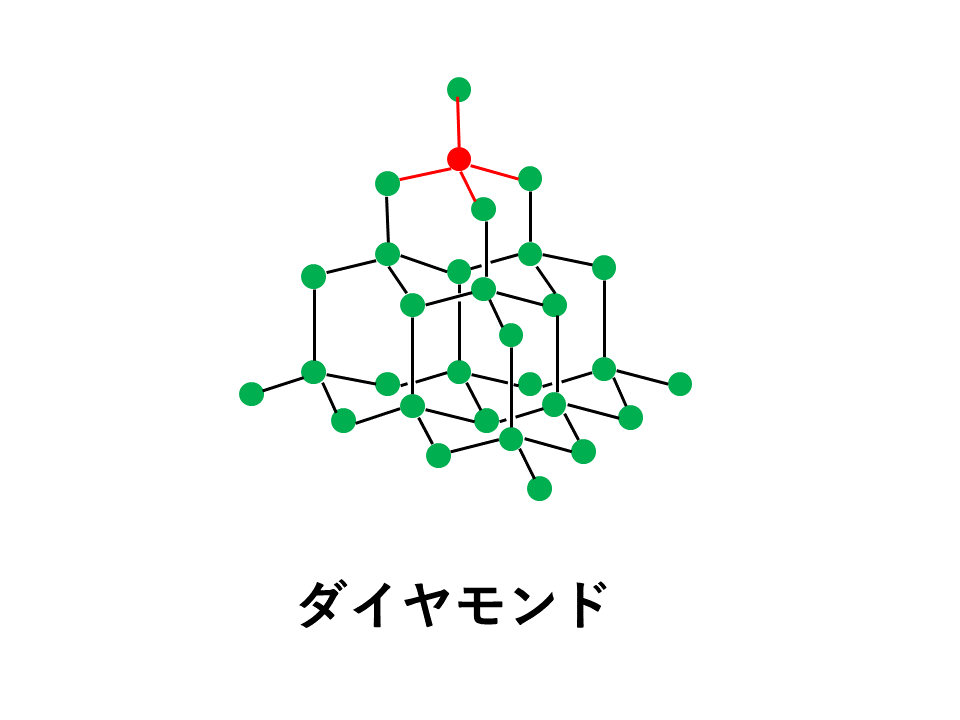
このため、4組の共有電子対はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、空間的に最も遠ざかる位置に配置されます。4本の結合すべてを最大限に遠ざけると以下の図のように正四面体の頂点の方向に配置されることになります。
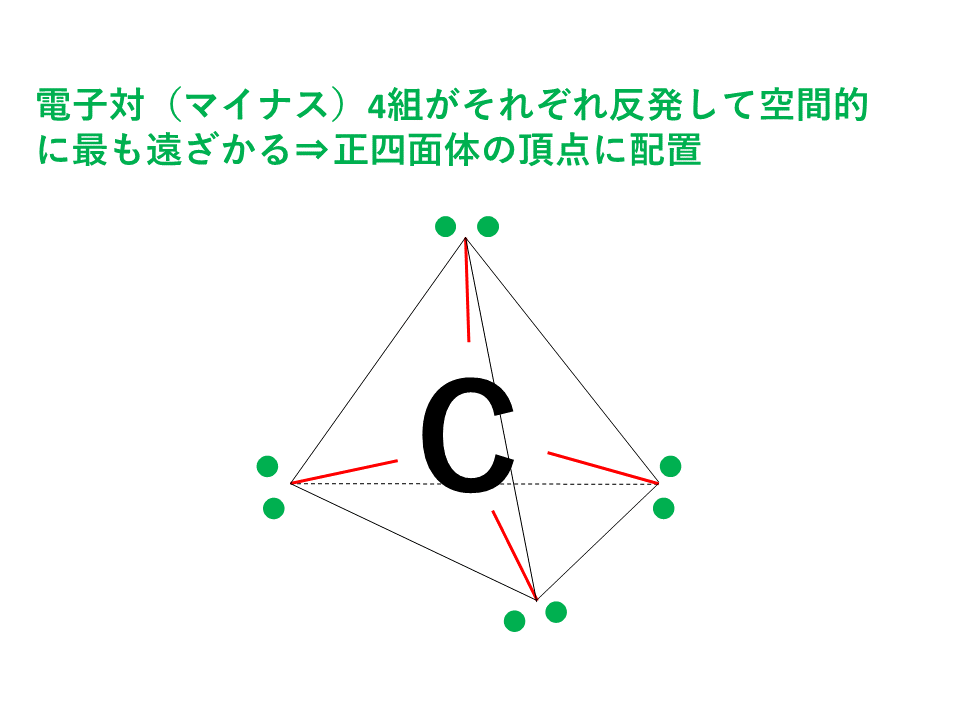
そのため、ダイヤモンドは立体的で巨大な構造を形成しています。
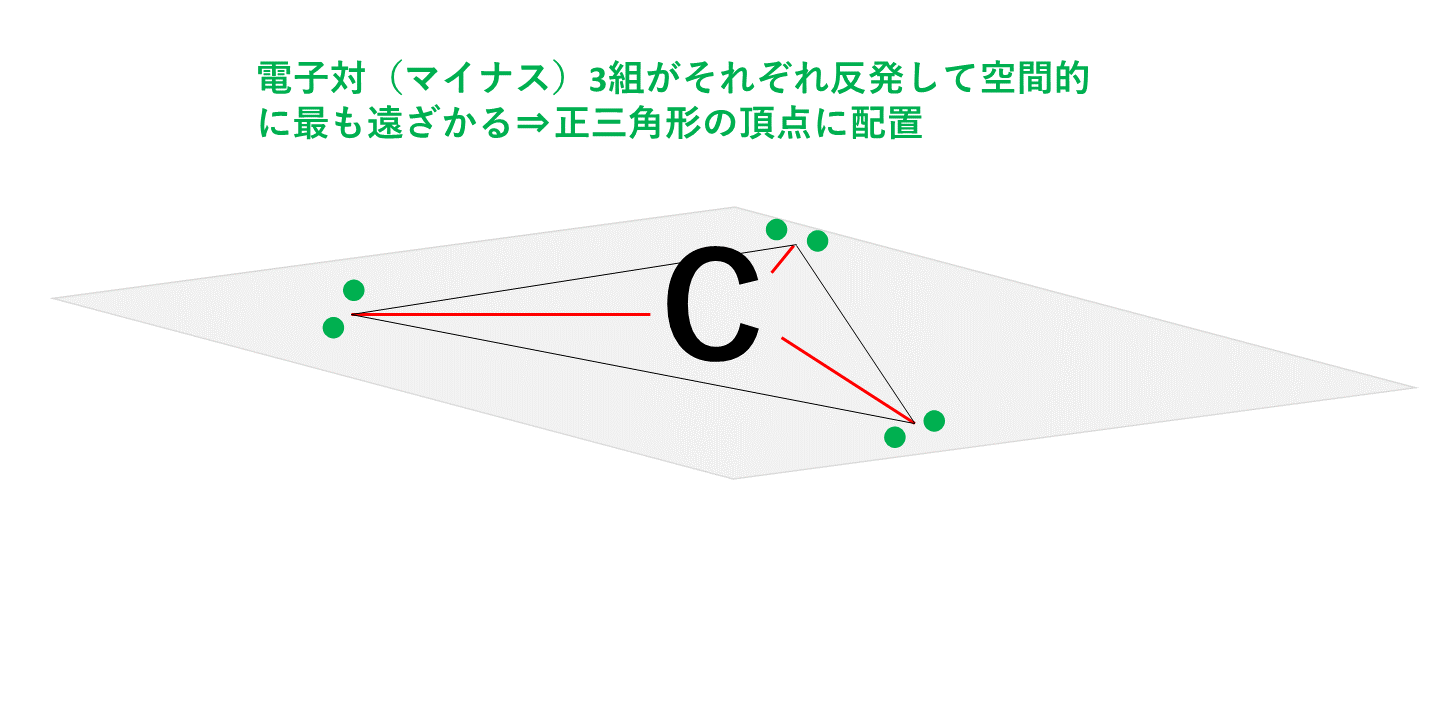
これに対し、黒鉛の場合、炭素Cの価電子4個のうち3個を結合に使います。
このため、3組の共有電子対はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、空間的に最も遠ざかる位置に配置されます。3本の結合すべてを最大限に遠ざけると以下の図のように正三角形の頂点の方向に配置されることになります。
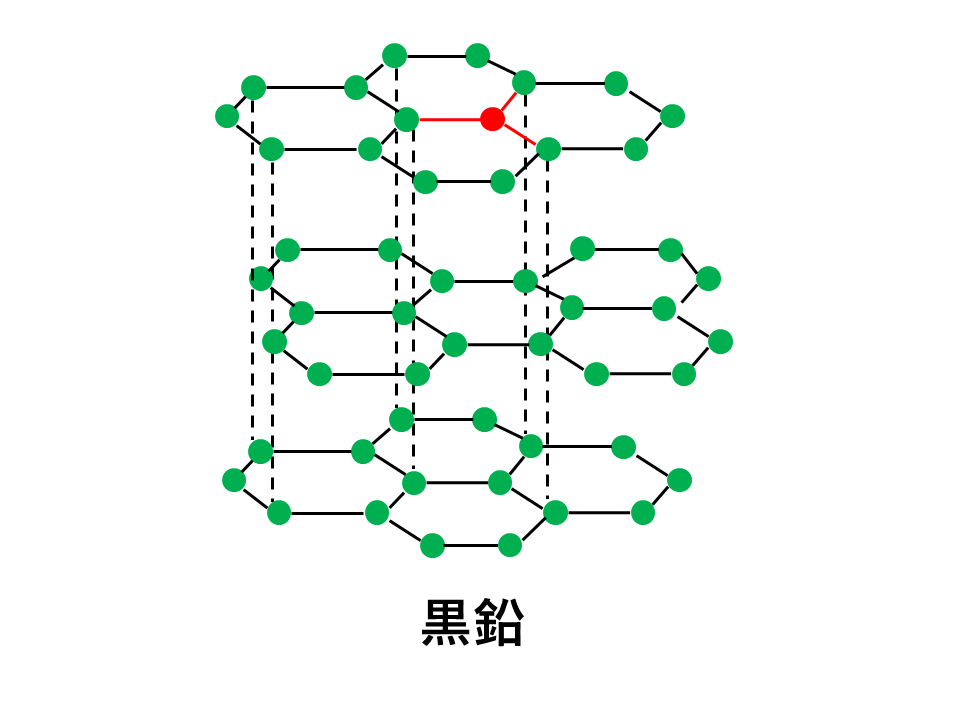
そのため、黒鉛は網目状の平面構造を作り、その平面同士が非常に弱い力であるファンデルワールス力によって結合し形成されています。
ダイヤモンドと黒鉛の機械的性質

上の構造で分かる通り、ダイヤモンドは立体的に共有結合しており、結合自体が非常に強いため極めて硬いです。

それに対し、黒鉛は非常に強い共有結合で平面状につながっており、平面どうしは非常に弱いファンデルワールス力でつながっているため、薄くはがれやすくやわらかいという性質を持っています。
鉄板のように固い板を木工ボンドのように弱い力でくっつけたようなイメージです。

鉛筆で文字が書ける理由は、鉛筆の芯と紙との摩擦でファンデルワールス力が切れて、黒鉛の層が薄くはがれ、紙にひっつくからです。
ダイヤモンドと黒鉛の電気伝導性
ダイヤモンドは価電子4個すべてを結合に使っているため、電気を導かず、電気伝導性はありません。
これに対し、黒鉛は価電子4個のうち3個を結合に使い、残り1個の電子は結晶中を自由に移動できるため、金属の自由電子のときのように黒鉛は電気をよく導き、電気伝導性があります。
ダイヤモンドと黒鉛の性質まとめ
| ダイヤモンド | 黒鉛 | |
| 結合に使われる電子の数 | 4個全て | 3個 |
| 結合の仕方 | 正四面体の頂点の方向 | 正三角形の頂点の方向 |
| 構造 | 立体的 | 平面構造で層状 |
| 融点・沸点 | 共有結合が非常に強いので非常に高い | |
| 機械的性質 | 極めて硬い | 薄くはがれやすくやわらかい |
| 電導性 | なし | あり |
さいごに
黒鉛とダイヤモンドがまさか同じ物質からできているとは信じがたいですね。講義をする立場にいる僕でも信じられないくらいですが、事実なので認めましょう。
出題頻度としては、それなりに高いほうではありますので、最も重要な要素である価電子のうち共有結合に使われる電子数が3なのか4なのかということを覚え、それをもとに性質を”理由とともに“説明できるようになればOKです。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。