電気陰性度とは、つまるところ電子の引きつけ度合いのことです。共有結合の極性との関係性や、周期表での大小関係について、入試で出題されることがあるマリケンやポーリングの電気陰性度についても具体的かつ丁寧に解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
電気陰性度の定義と共有結合
電気陰性度とは共有電子対を各原子が引き寄せ,自らを電気的に陰性にしようとする強さの尺度のことです。
それでは細かく解説していきましょう。
2つの原子がお互いに「不対電子」というものを出し合って「共有電子対」というペアになった電子をつくり、これを共有する事によってその2つの原子が結合することを共有結合といいます。
詳しくは共有結合とは?二酸化炭素などの例を図で完全解説を参照ください。
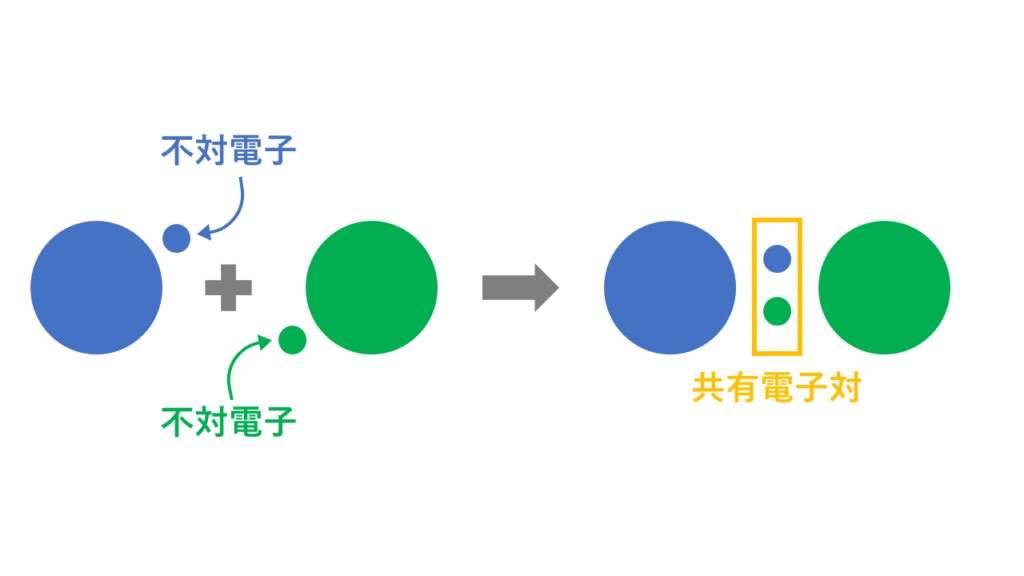
それぞれの原子が共有電子対を自分の方に引っ張る強さを電気陰性度といいます。
つまり、電気陰性度が大きい原子の方が共有電子対を自分側に引き寄せます。
電気陰性度と結合の極性
電気陰性度が大きい原子の方が共有電子対を自分側に引き寄せます。
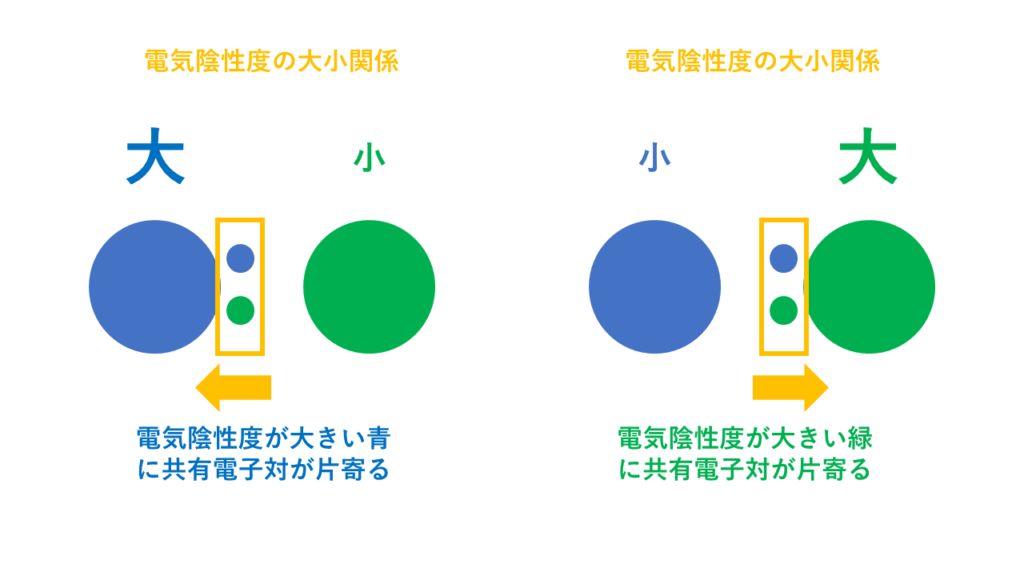
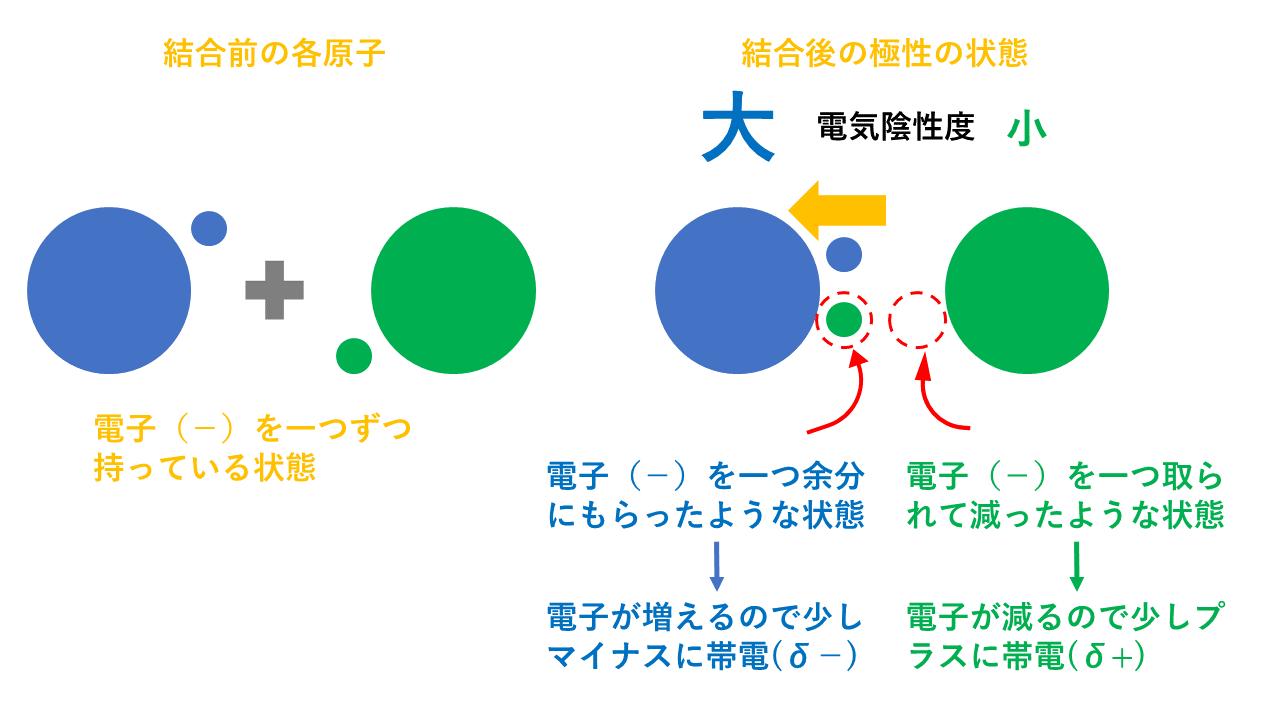
この結果、分子内において、電気陰性度が大きい原子の方に電子が片寄ることとなり、電気的な偏りが生じることになります。この偏りが「結合の極性」の原因となります。
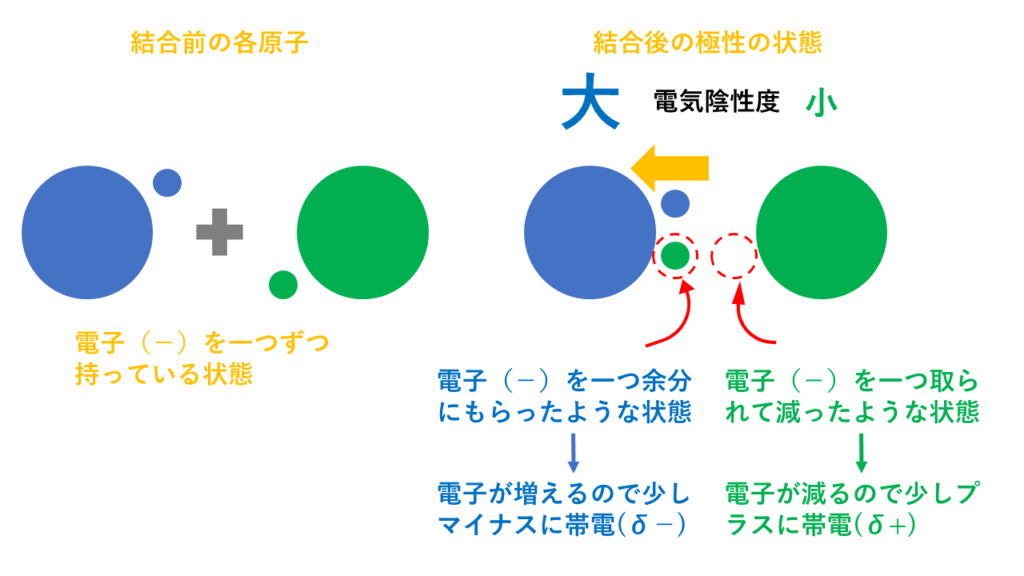
電気陰性度が大きい方の原子(上の図でいうと青)は共有電子対を自分の方に引っ張るため少しマイナスに帯電します【δ-(デルタマイナスと読みます)】。
反対に、電気陰性度が小さい方の原子(上の図でいうと緑)は共有電子対を他方に引っ張られているため少しプラスに帯電します【δ+(デルタプラスと読みます)】。
ちなみに、この極性が非常に強くなるとイオン結合となります。
詳しくは共有結合とは?二酸化炭素などの例を図で完全解説を参照ください。
電気陰性度は周期表の右上が大きい
高校範囲で学習する電気陰性度は2種類あります。
ただし、不正確な点があるため、現在は使われていません。
東大でテーマとして出題されたこともあります。計算式は覚える必要はありません。
高校範囲での電気陰性度の数値はこのポーリングの値です。
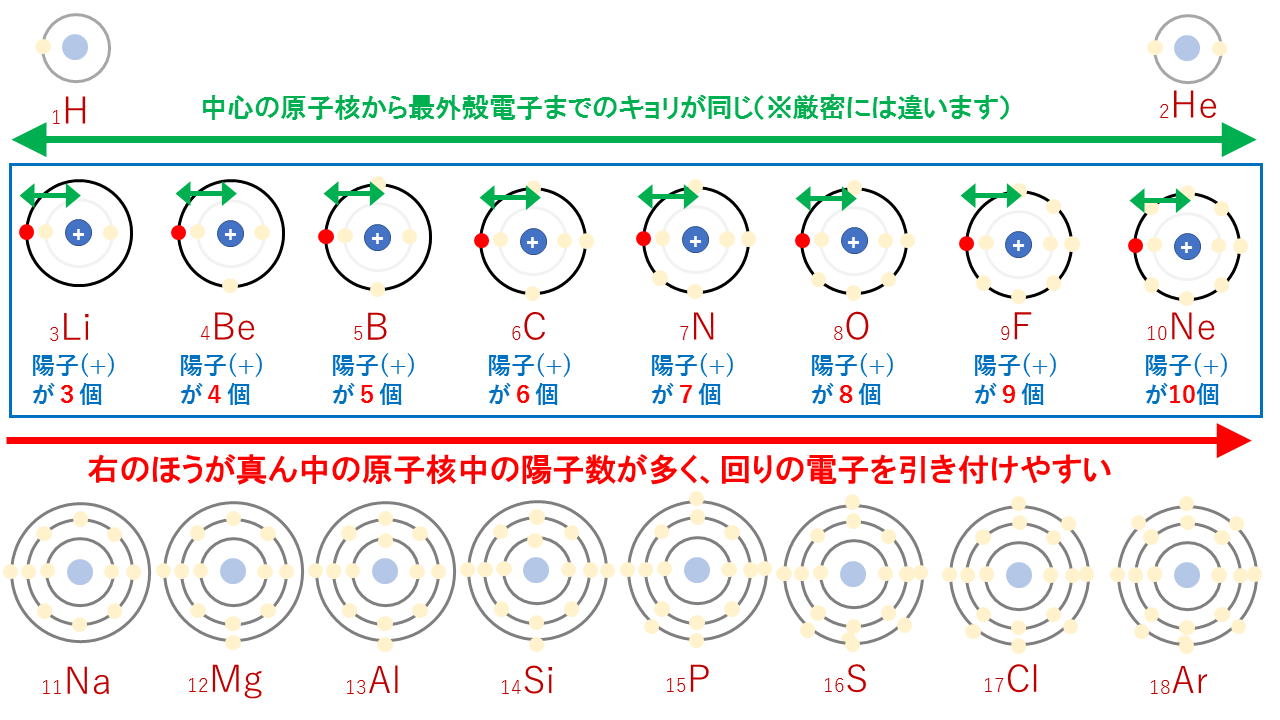
電気陰性度は電子を引き付ける力の強さなので、イオン化エネルギーや電子親和力のように、周期表の右上にいくほど大きく、左下に行くほど小さくなる傾向があります。
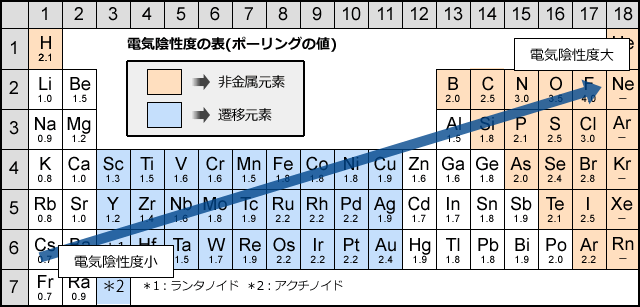
出典:https://blog.donaldo-plan.com/
以下の2点が注意点です。
イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径について
根本的な考え方が同じである「イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径」についての他記事は以下を参照ください。
さいごに
共有結合の理解を深めるうえで重要というか必須となるこの「電気陰性度」。最大がフッ素であることくらいは覚えておくといいです。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。