酸・塩基の定義の仕方であるアレニウスの定義、ブレンステッドとローリーの定義。その違いは絶対的な定義か、相対的な定義か、ということができます。本記事では、この意味を理解してもらうための解説、練習問題を通じて酸・塩基の判断の仕方、塩基とアルカリの違いなど、例を示しながらわかりやすく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
酸・塩基の定義(塩基とアルカリの違い)
塩酸や硫酸、硝酸などの「酸」と水酸化ナトリウムや水酸化カルシウム、アンモニアなどの「塩基」について解説していきます。
「塩基」と「アルカリ」の違いについて解説します。
小学生の時にも習い、馴染みがある「アルカリ」というのは、「塩基」よりも少し狭い概念です。
「塩基」の中で水に溶けた物が「アルカリ」なのです。つまり、「塩基」は水に溶けていないものも含みます。
では、どのようにして「酸」と「塩基」が定義されているのでしょうか。
高校化学では、「酸」と「塩基」にはアレニウスによる定義と、ブレンステッドとローリーによる定義の2種類があります。
アレニウスの定義
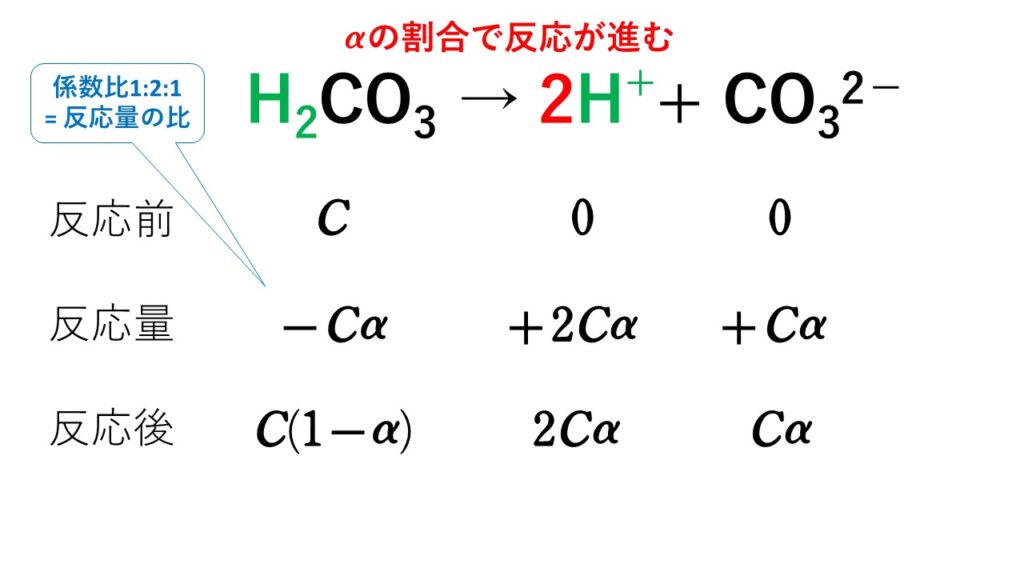
酸とは、水溶液中で水素イオンH+を放出する水素化合物のことです。
塩酸HCl → H+ + Cl-
硫酸H2SO4 → 2H+ + SO42-
硝酸HNO3 → H+ + NO3-
酢酸CH3COOH → CH3COO- + H+
生成した水素イオンH+は,水溶液中では水分子と結合してオキソニウムイオンH3O+
として安定に存在しています。
塩基とは、水溶液中で水酸化物イオンOH-を放出する物質のことです。
水酸化ナトリウムNaOH → Na+ + OH-
水酸化カリウム KOH → K+ + OH-
水酸化カルシウムCa(OH)2 → Ca2+ + OH-
アンモニア NH3 + H2O → NH4+ + OH-
しかし、アレニウスの定義には欠点がありました。
(ⅰ) 「水溶液中」と限定しているため、水以外を溶媒とする溶液中の場合など酸・塩基の区別ができない。
(ⅱ) そもそも水にほとんど溶けないFe(OH)3やAl(OH)3が塩基であることの説明ができない。
(ⅲ) ヒドロキシ基-OHをもたないアンモニアは、OH-を放出しているとは言い難く、実質的に塩基性を示すことの十分な説明ができない。
このため、新たにブレンステッドとローリーが酸と塩基の定義を提唱しました。
ブレンステッドとローリーの定義
酸とは水素イオンH+ を与えることのできる物質であり,塩基とは水素イオンH+ を受け取ることの
できる物質である。
と定義しました。「水溶液」と限定していないため、上記の欠点の2つが解決されます。アンモニアに関しては具体例をもとに説明していきます。
【例1】塩酸HClと水H2Oの反応について
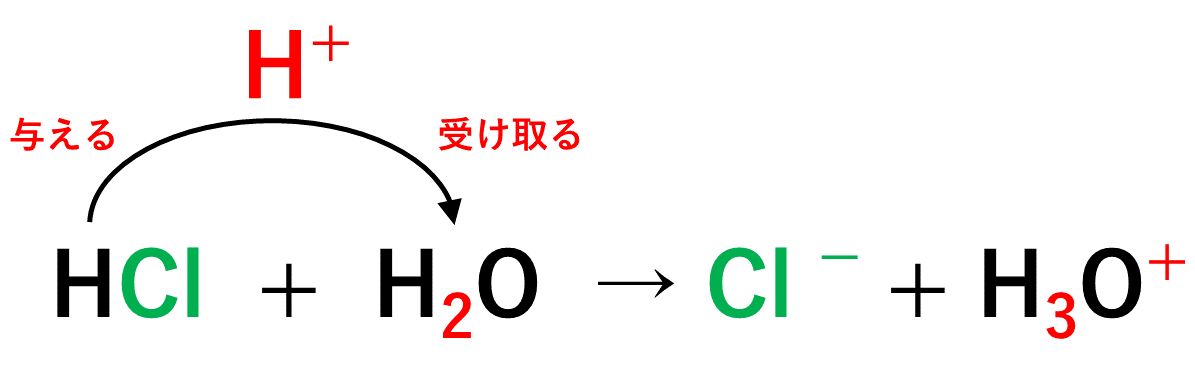
この反応では、HClがH+を放出して自身はCl-となり、放出されたH+をH2Oが受け取りH3O+になります。そのため、ブレンステッド・ローリーの定義によれば、HClが酸として働き、H2Oが塩基として働いた事になります。
【例2】水H2OとアンモニアNH3の反応について
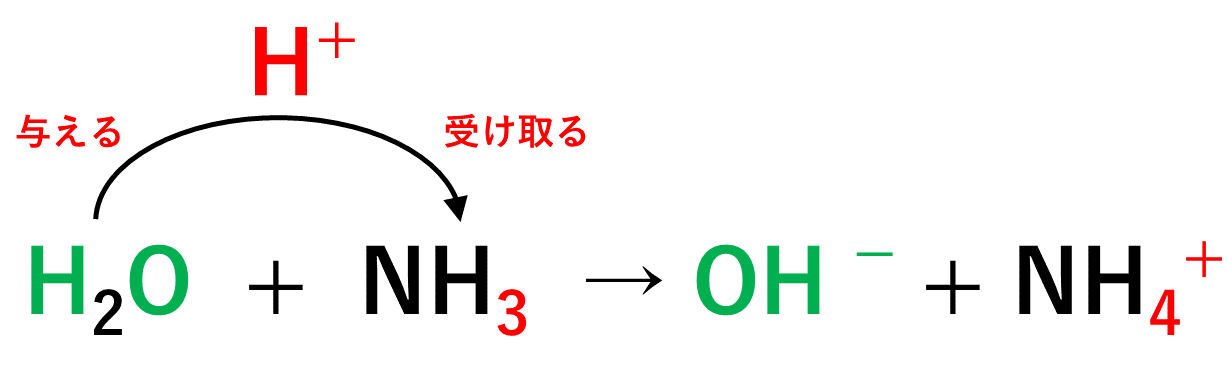
この反応では、H2OがH+を放出して自身はOH-となり、放出されたH+をNH3が受け取りNH4+になります。そのため、ブレンステッド・ローリーの定義によれば、H2Oが酸として働き、NH3が塩基として働いた事になります。
【例3】水酸化鉄(Ⅲ)Fe(OH)3と水素イオンH+の反応について
さて、それでは
Fe(OH)3 + 3H+ → Fe3+ + 3H2O
の反応だといかがでしょうか。
H+のやりとりには見えないですよね。
こういうときの裏技があります。
ブレンステッドとローリーの裏定義です。(正式名称ではありません)
塩基とは水酸化物イオンOH- を与えることのできる物質であり,酸とは水酸化物イオンOH-を受け取ることのできる物質である。
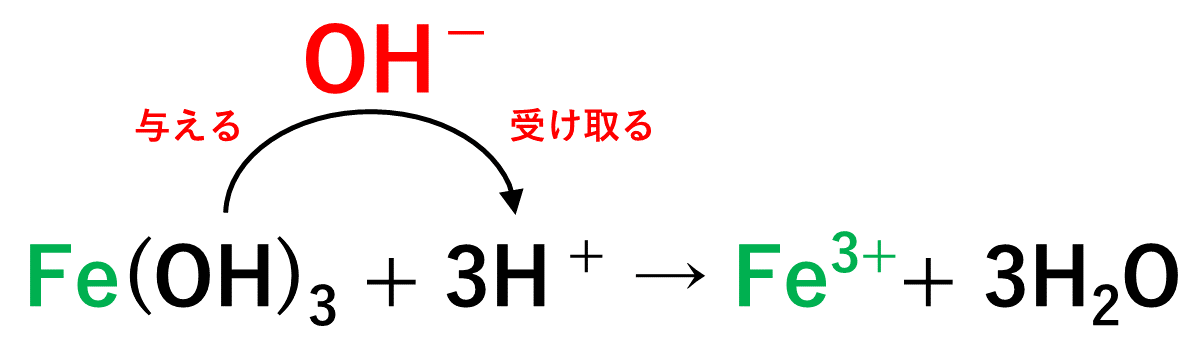
この「裏定義」をもとに考えると、Fe(OH)3がOH-を放出して自身はFe3+となり、放出されたOH-をH+が受け取りH2Oになります。そのため、Fe(OH)3が塩基として働き、H+が酸として働いた事になります。
酸塩基の価数について詳しく知りたい方は以下から。
酸塩基の強弱について詳しく知りたい方は以下から。
さいごに
アレニウスの定義とブレンステッドとローリーの定義の違いは理解できましたか?それほど出題頻度は高くありませんが、基礎知識にはなりますので、復習しておきましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。