再結晶とは、溶解度の差を利用して固体どうしの混合物を分離する方法です。計算問題でも頻出の「再結晶法」の原理と方法を、硝酸カリウムと塩化ナトリウムを例に解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
再結晶とは
再結晶とは、溶解度の差を利用して固体どうしの混合物を分離する方法です。
固体の溶解度とは溶媒(液体)100gに溶け得る最大の質量のことです。物質の溶解度は温度により変わるため、このときの溶解度の差を利用して物質を分離します。この方法で析出させ取り出す事ができる物質は、温度によって溶解度が大きく異なる物質です。
【頻出の具体例】KNO3とNaClの混合物の分離
硝酸カリウムKNO3は温度による溶解度の差が非常に大きいため、高温のKNO3飽和水溶液を冷却すると、多くの固体が析出します。
それに対し、塩化ナトリウムNaClは温度による溶解度の差が小さいため、同じように高温のNaCl飽和水溶液を冷却してもほとんどNaClの固体は析出しません。
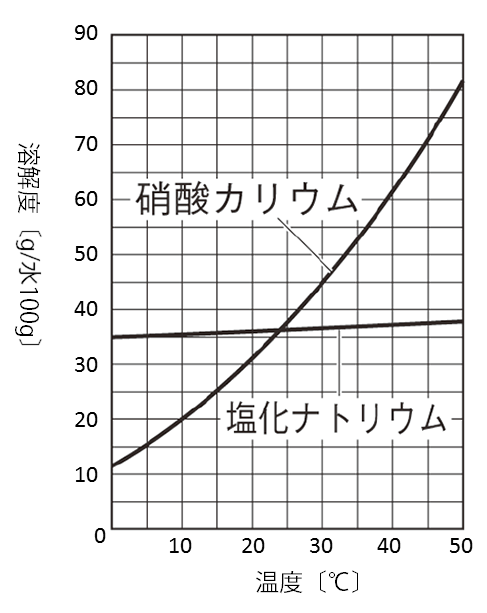
そのため、KNO3とNaClの混合物を高温で高濃度の水溶液にした後に冷却すると、純粋なKNO3を固体として分離する事ができます。
さいごに
分留やクロマトグラフィーなどに比べると比較的なじみのある再結晶ですが、意外と忘れる箇所だと思います。
選択肢から分離法の名称と具体例の組み合わせを選ぶ問題などが出題されることがありますので、対応できるようにその他の分離法も含めて覚えておきましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。