【アニメーション解説】極性分子か無極性分子かの判断は、結合自体の極性を電気陰性度をもとに考え、その後分子の形から重心の一致か不一致かを確認して判断しなければいけません。本記事では、結合の極性の有無の考え方、なぜ分子が正四面体、三角錐、折れ線、直線、正三角形になるのか、重心が一致するのか不一致するのかをすべて丁寧に解説し、自分自身で極性分子か無極性分子かを判断できるようになってもらいます。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
結合の極性と電気陰性度
同じ種類の原子間に働く共有結合では、電荷の偏りは生じませんが、異なる種類の原子間に働く共有結合の場合、電気陰性度の違いに基づいた電荷の偏りが生じます。つまり、電気陰性度が大きい原子の方に共有電子対が引き寄せられ、その原子がマイナスに帯電し、もう一方の原子は正に帯電します。
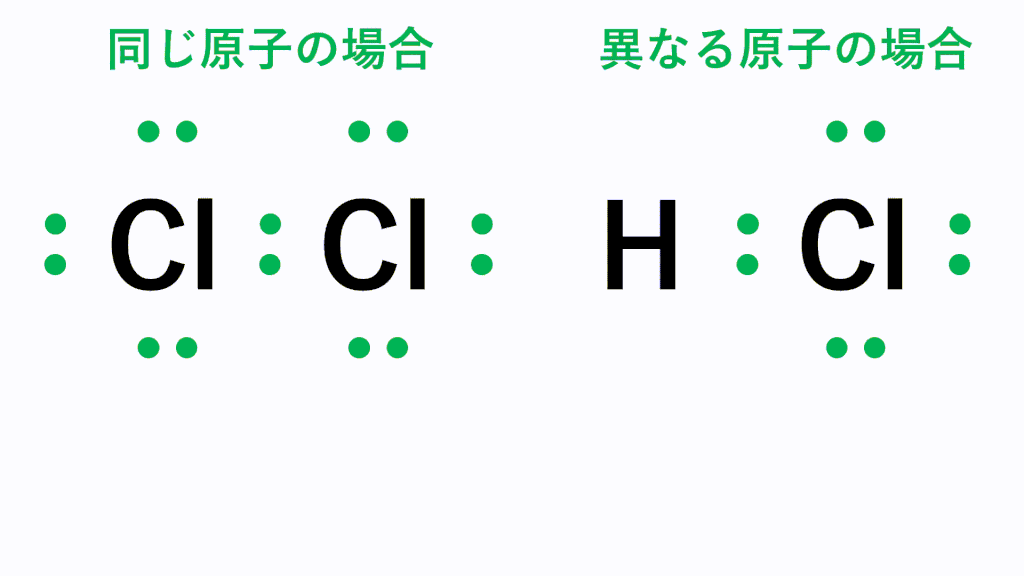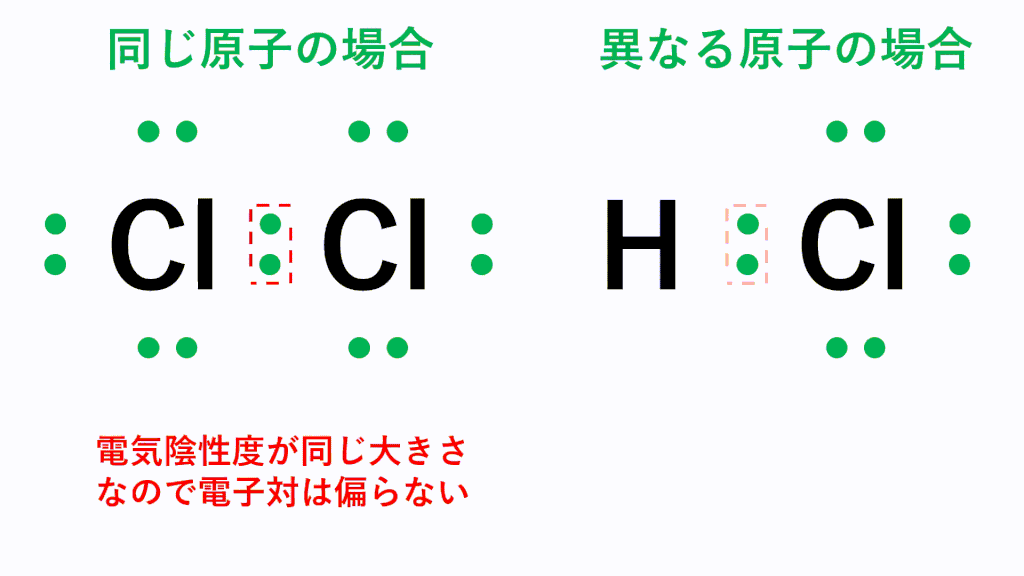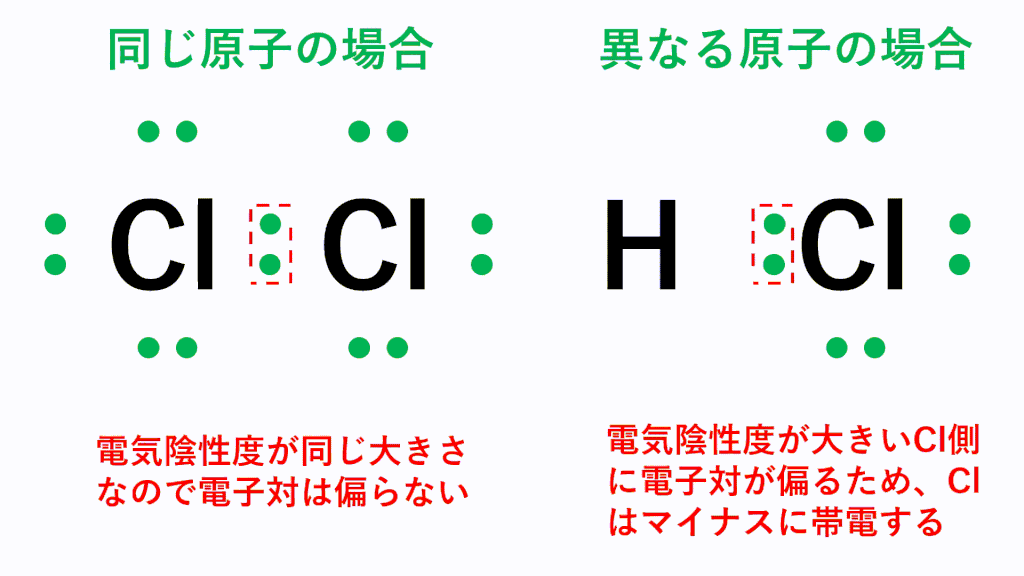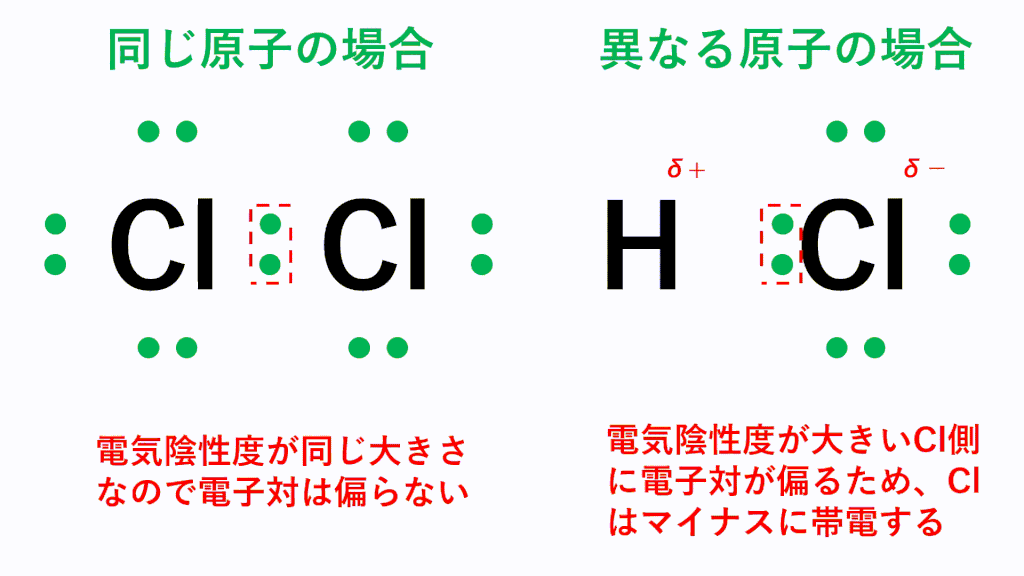
例えば塩化水素HClでは、電気陰性度が大きいCl原子の方に共有電子対が引き寄せられ、Cl原子がδ-(デルタマイナス)に帯電し、もう一方のH原子はδ+(デルタプラス)に帯電します。このように、原子間の電気陰性度の差によって生じる電荷の偏りを極性といい、極性を持つ分子を極性分子といいます。
※δ(デルタ)は“少し”という意味です。普通に+(プラス)や-(マイナス)と書くとイオンの意味になってしまい、共有された電子対が偏るレベルではなく、完全に電子を与えたことになってしまいます。そのため、イオンと区別するためにδを使っています。
一方、塩素分子Cl2では、同じ種類の原子が結合しているため、電気陰性度に差がなく、共有電子対は偏りません。このように極性を持たない分子を無極性分子といいます。
分子間力(ファンデルワールス力・極性引力・水素結合)とはで説明していますが、
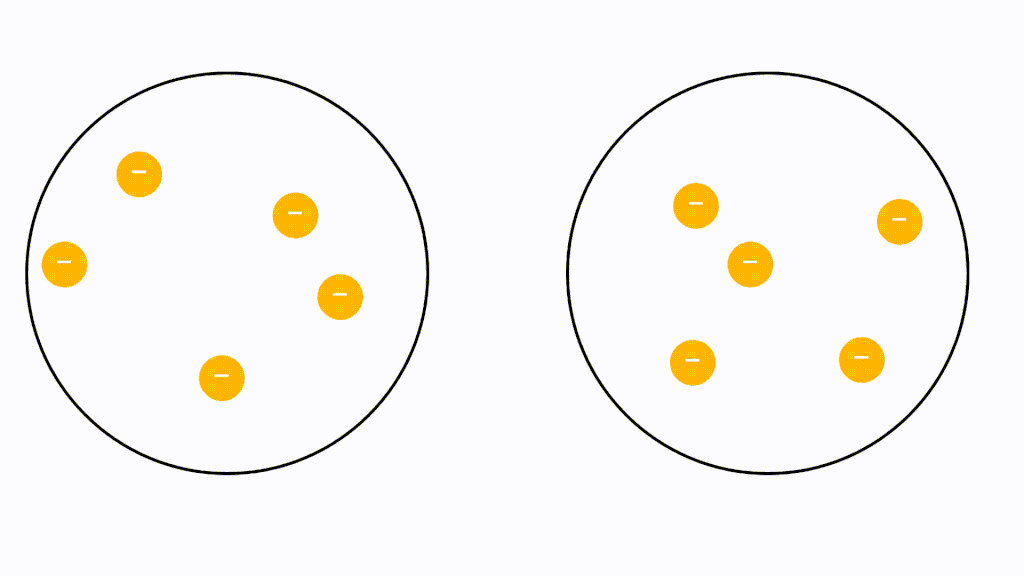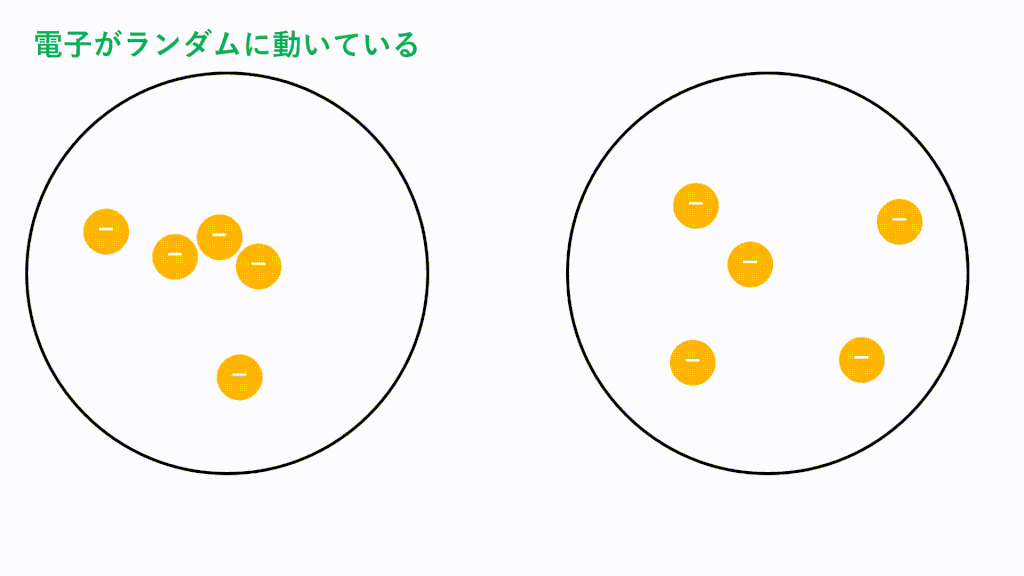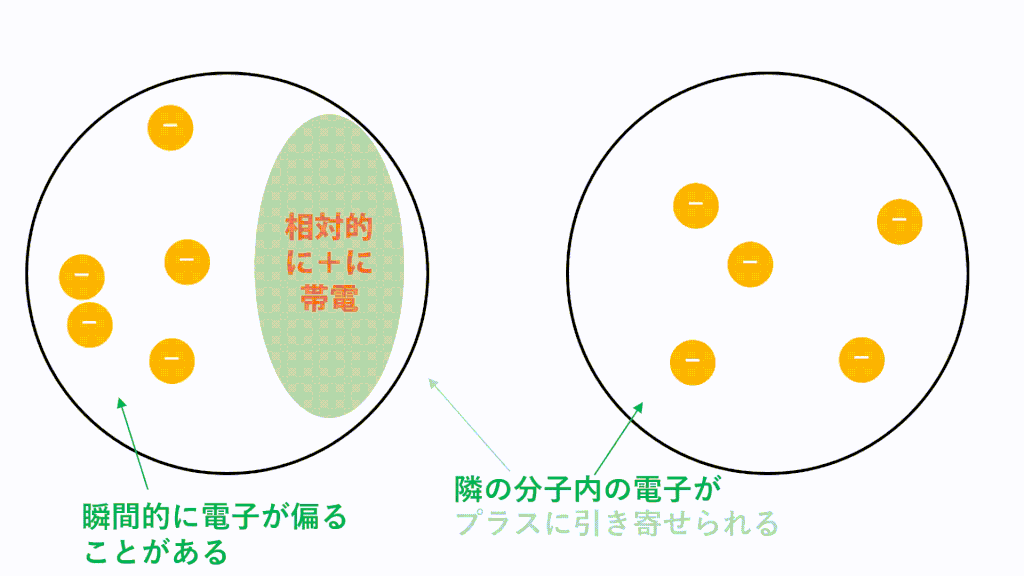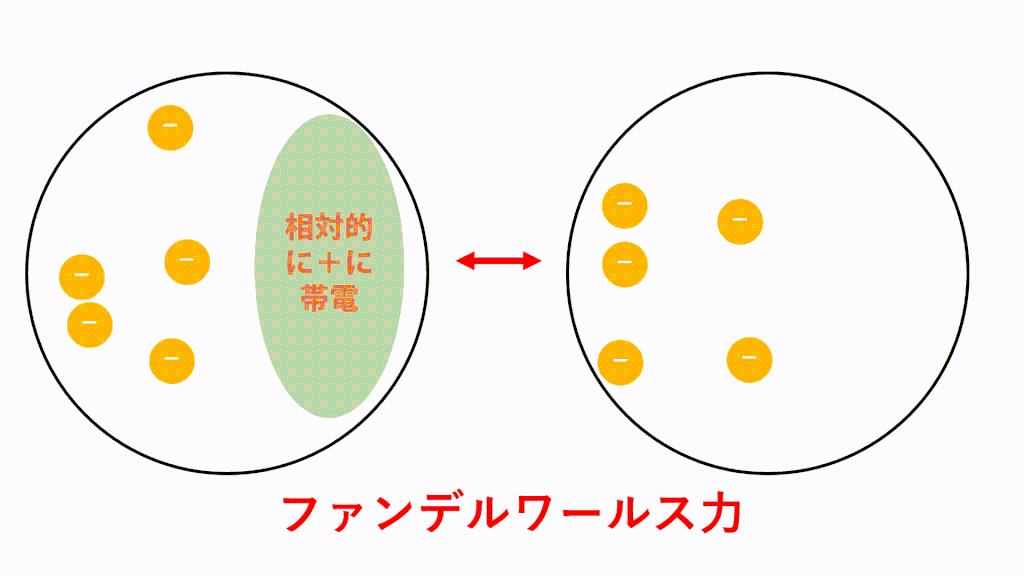
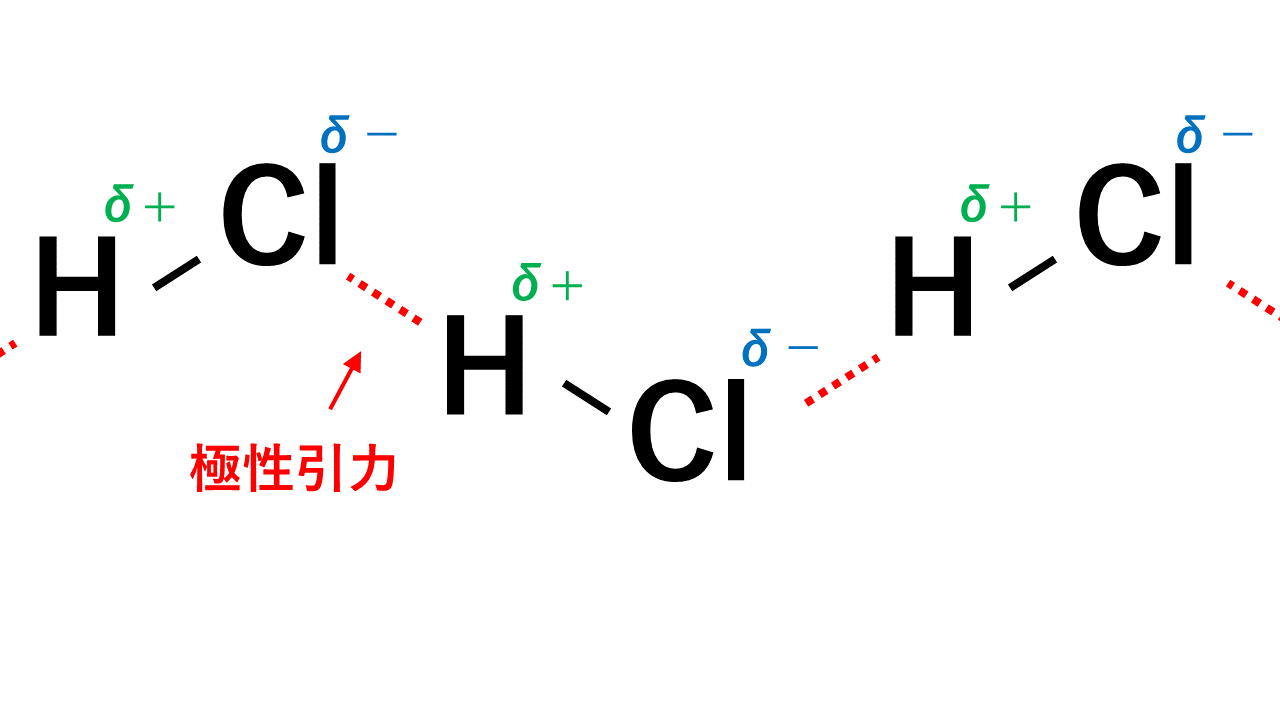
無極性分子の場合、どんな分子でもはたらくファンデルワールス力という引力しかはたらきません。
それに対し、極性分子どうしには極性引力という力がプラスアルファで働き、引き付けあっています。
例えばHClの場合、Hがδ+,Clがδ-なので、一つのHCl分子中のH(δ+)と隣のHCl分子のCl(δ-)が引き付けあいます。
それでは、原子間の電気陰性度に差があり、結合に極性があれば、必ず極性分子かというと、そういうわけではありません。
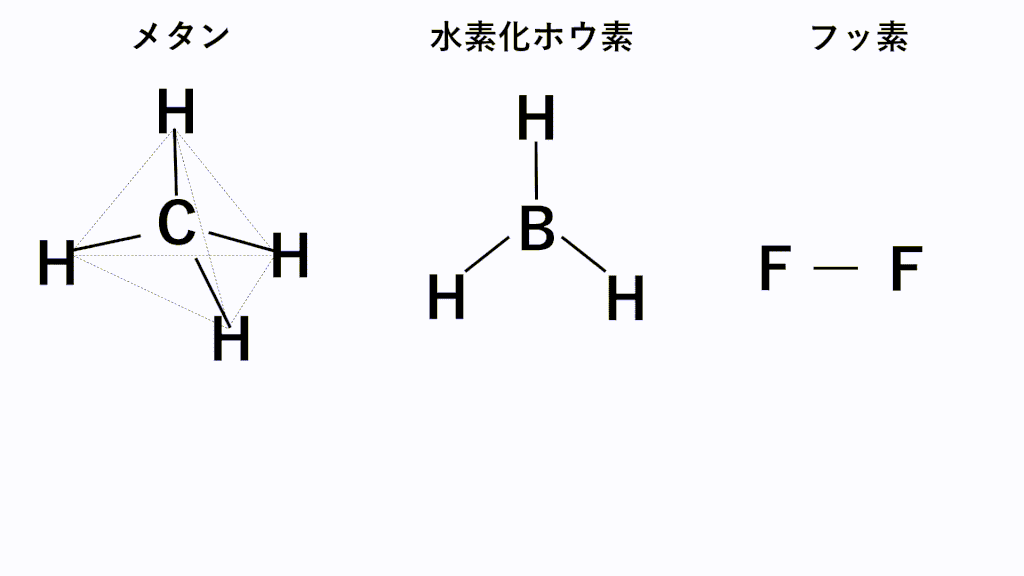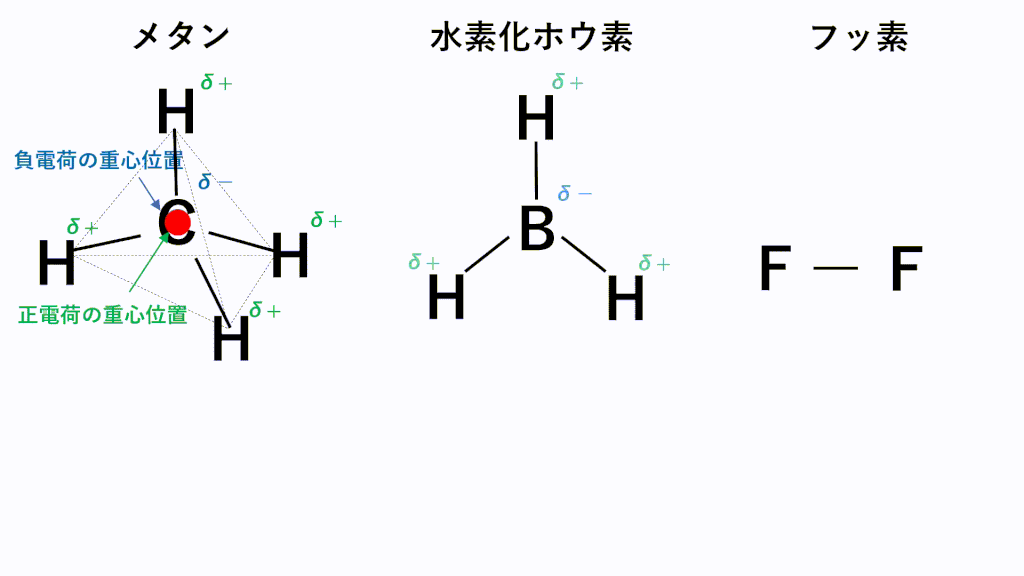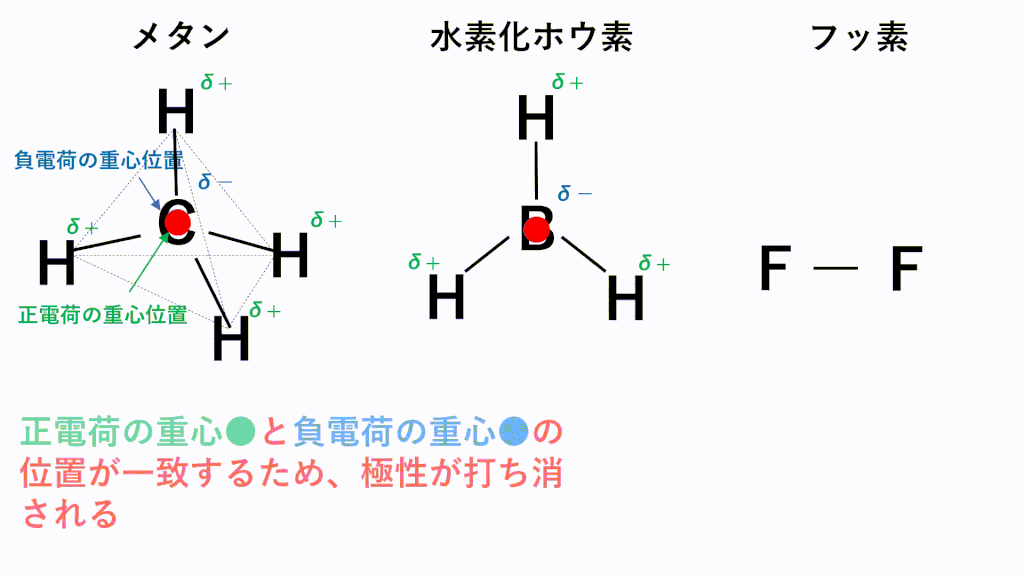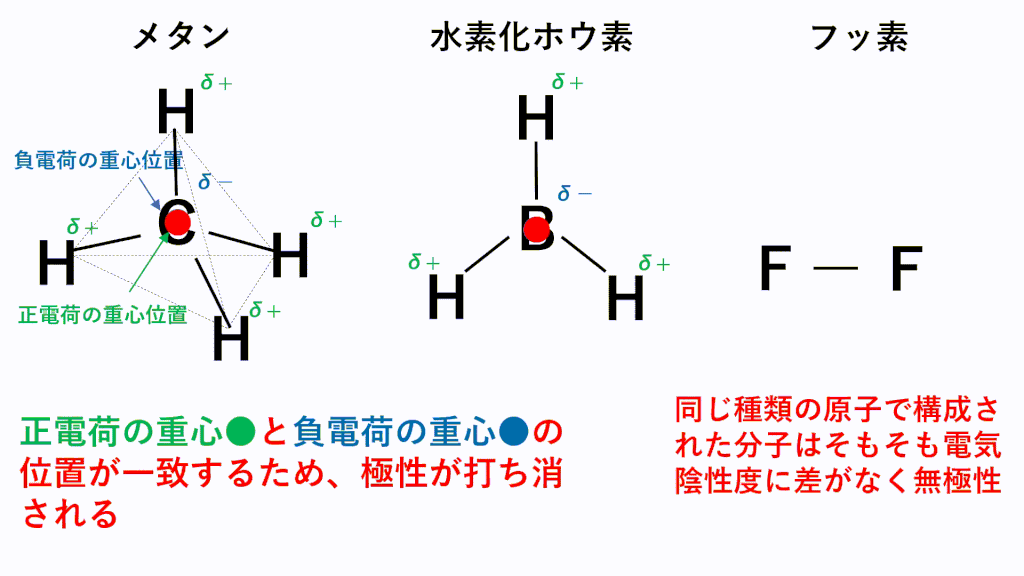
結合自体に極性があっても、以下のように正電荷と負電荷の重心が一致することで極性が打ち消されてしまい無極性分子に分類されることもあります。
上記の図から見てもわかるように、分子の形を考えられるようになることが非常に重要なのですが、どのようにして分子の形を考えればよいのでしょうか。
分子の形の考え方
上記でも説明の通り、結合に極性があったとしても、分子の形の影響で全体に極性があるかどうかが変わります。ただの丸暗記ではなく、理屈を理解しておき、自分が知らない分子の形も考えられるようにしましょう。
以下の手順で分子の形を決定します。
STEP2.正四面体ベース、正三角形ベース、直線ベースのどれかを考える
STEP3.分子の形を決定
正四面体ベースの分子の形
共有電子対、非共有電子対を問わず、電子対が4セットある場合は正四面体ベースとなります。
4組の電子対はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、空間的に最も遠ざかる位置に配置されます。4組の電子対すべてを最大限に遠ざけると以下の図のように正四面体の頂点の方向に配置されることになります。
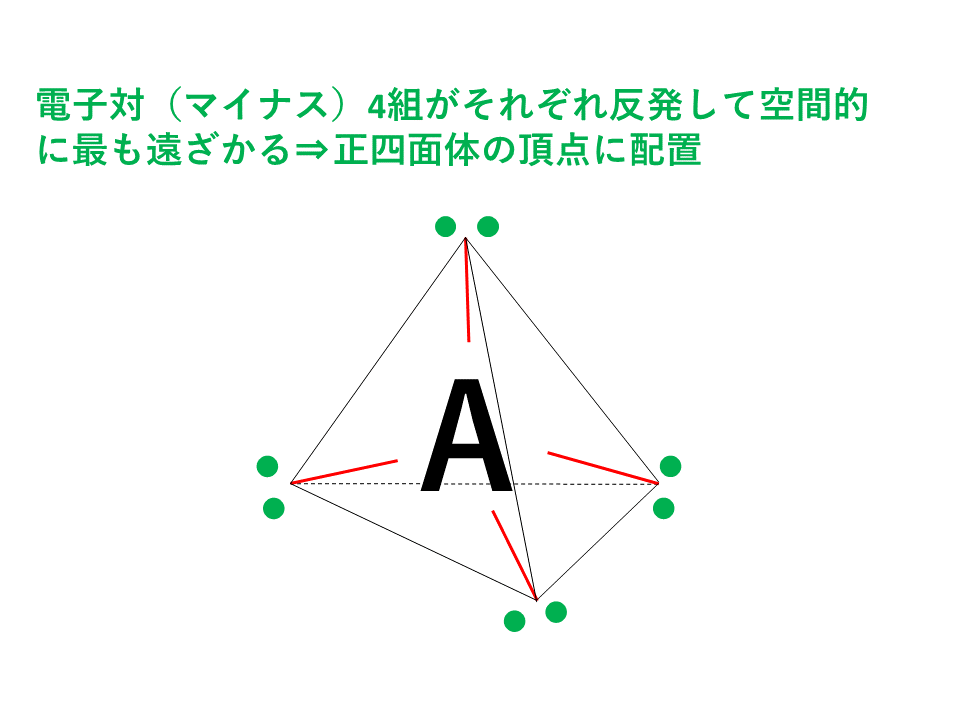
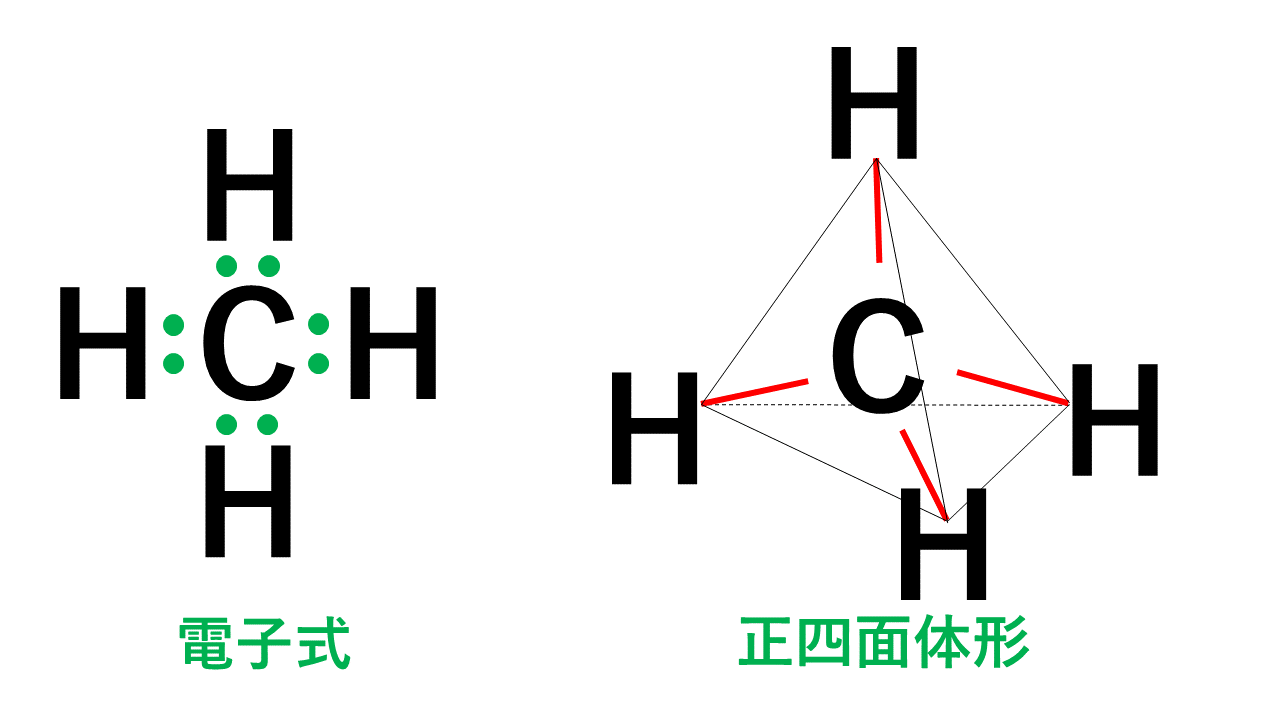
正四面体形
代表例はメタンCH4です。
4組の電子対はすべて水素原子Hとの間の共有電子対です。そのため、右図のように水素原子Hを結ぶと正四面体形となります。
三角錐形
代表例はアンモニアNH3です。
4組の電子対のうち3組が水素原子Hとの間の共有電子対です。そのため、右図のように水素原子Hと窒素原子Nを結ぶと三角錐形となります。
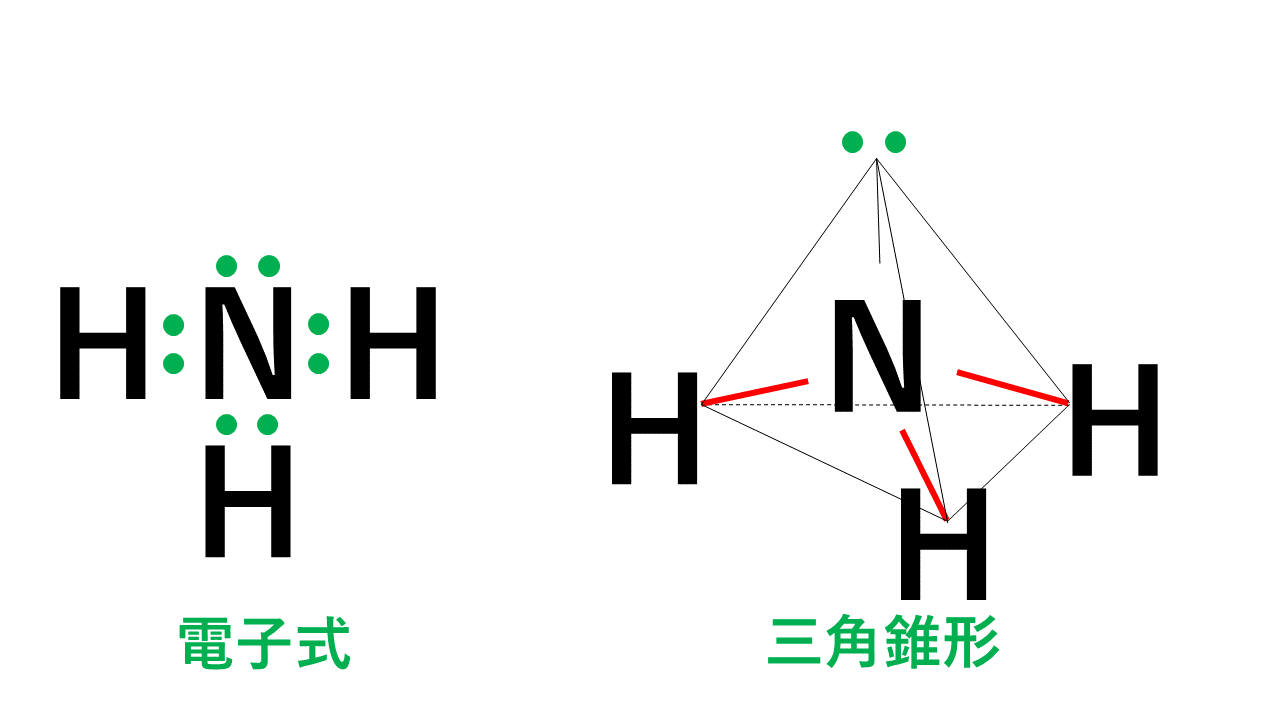
イメージとしては、電子対4つが反発して正四面体の頂点の方向に向くが、ひとつは非共有電子対のため空っぽ、それ以外の水素のところしか存在しないので、正四面体より少し潰れた三角錐になる、ということです。
折れ線形
代表例は水H2Oです。
4組の電子対のうち2組が水素原子Hとの間の共有電子対です。そのため、右図のように水素原子Hと酸素原子Oを結ぶと折れ線形となります。
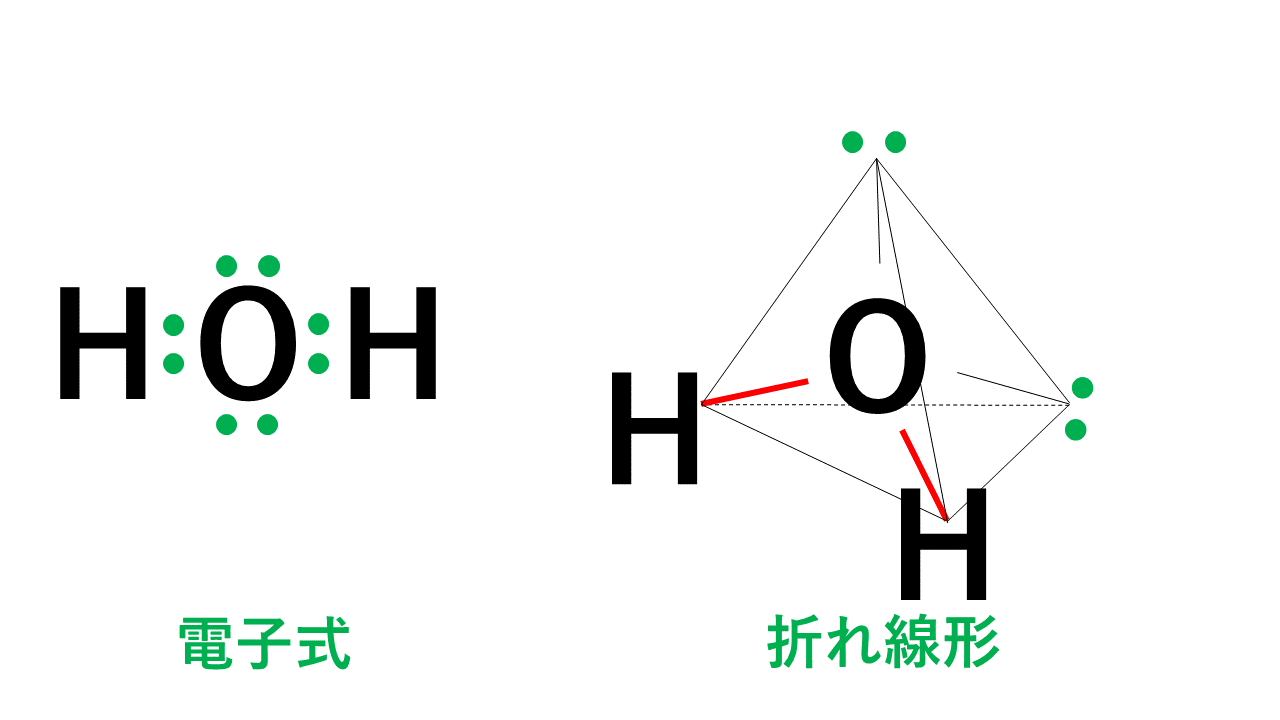
イメージとしては、電子対4つが反発して正四面体の頂点の方向に向くが、ふたつは非共有電子対のため空っぽ、それ以外の水素のところしか存在しないので、HとOとHを結ぶと折れ線形になる、ということです。
正三角形ベースの分子の形
共有電子対、非共有電子対を問わず、電子対が3セットある場合は正三角形ベースとなります。
3組の電子対はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、空間的に最も遠ざかる位置に配置されます。3組の電子対すべてを最大限に遠ざけると以下の図のように正三角形の頂点の方向に配置されることになります。
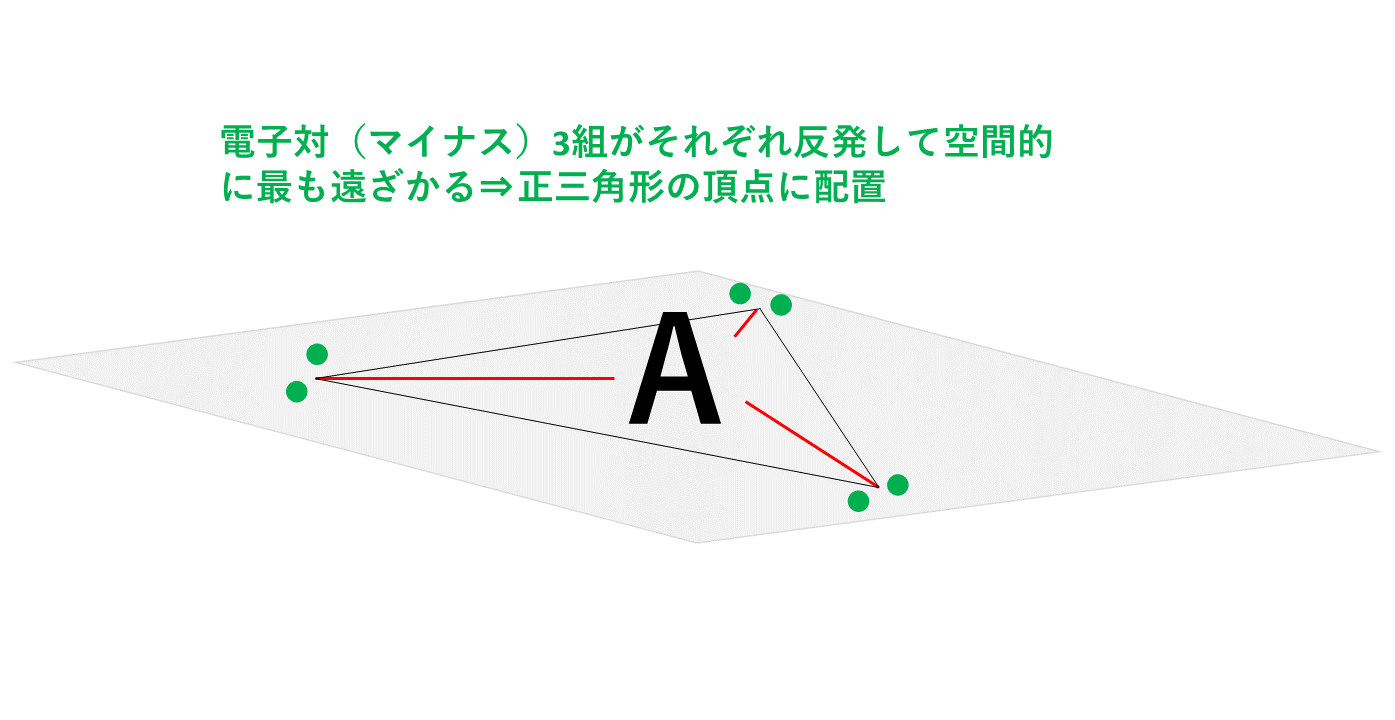
正三角形
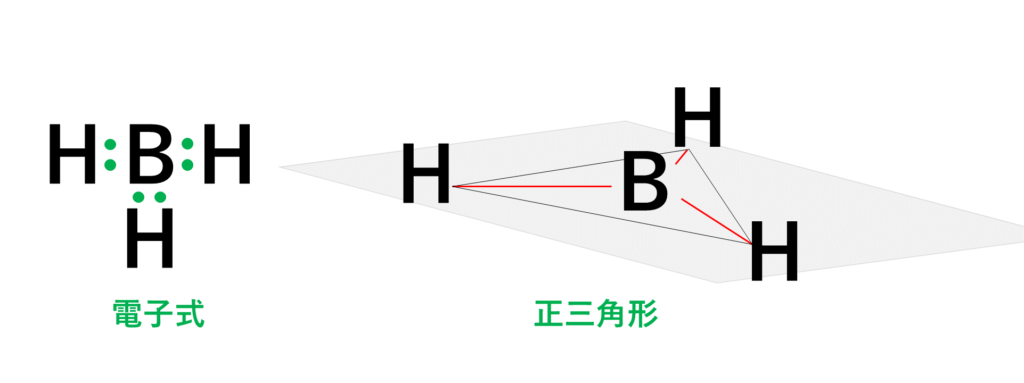
代表例は水素化ホウ素BH3です。
3組の電子対はすべて水素原子Hとの間の共有電子対です。そのため、右図のように水素原子Hを結ぶと正三角形となります。
直線ベースの分子の形
二パターンあります。
二原子分子の場合
水素H2,窒素N2,フッ素F2,塩素Cl2,フッ化水素HF,塩化水素HClなどの二原子分子(二つの原子で構成している分子)の場合は即座に直線形と判断可能です。
なぜなら、原子(点)2個を結んでも線にしかなり得ないからです。

ちなみにKClも二原子分子ですか?という質問を受けることがありますが、これはそもそも分子ではなくイオン結合なので、際限なく結合が続いていくため組成式で表されているため違います。
三原子以上の分子で直線形
共有電子対が2セットある場合は直線形となります。
代表例は二酸化炭素CO2です。
2組の二重結合はマイナスの性質をもった電子なので、クーロン力(静電気力)により反発しており、空間的に最も遠ざかる位置に配置されます。2組の二重結合を最大限に遠ざけると以下の図のようにCを中心に対称となる位置にOが配置されることになります。
そのため、二酸化炭素は直線形となります。

極性分子と無極性分子の判断の仕方
冒頭でも説明した通り、電気陰性度の異なる原子が共有結合すると,電気陰性度の大きい原子のほうが小さい原子より共有電子対をより強く引きつけるため,原子間に電荷のかたよりを生じます。このような電荷のかたよりを結合の極性といいます。
しかし、結合に極性があっても,その極性が互いに打ち消しあって,分子全体としては無極性分子になることもあります。分子全体としての極性の有無は,正電荷の重心と負電荷の重心が一致するかどうかを調べる必要があります。
極性分子
代表的な例でいうと、極性分子となるのはアンモニアNH3,水H2O,塩化水素HClなどです。
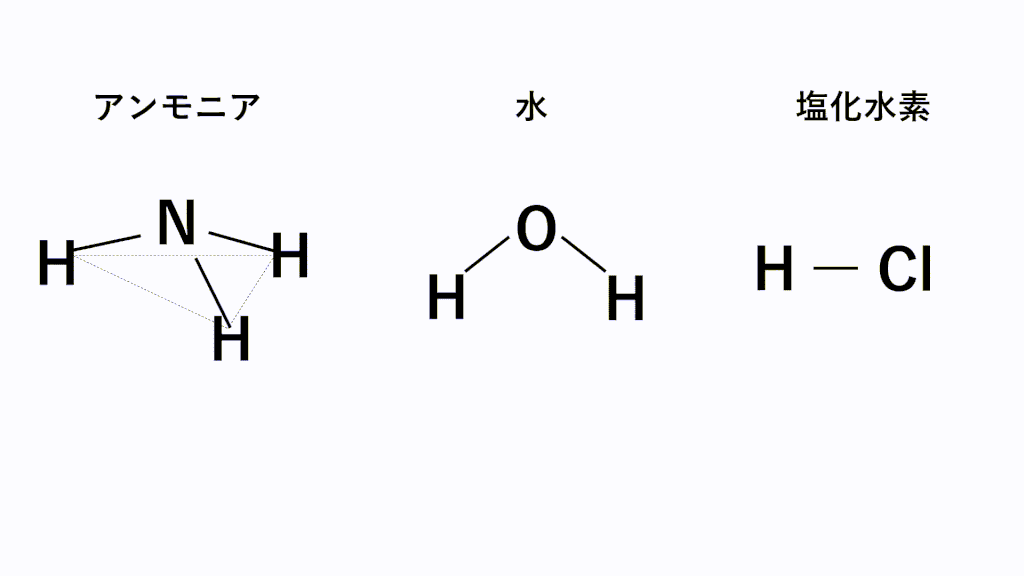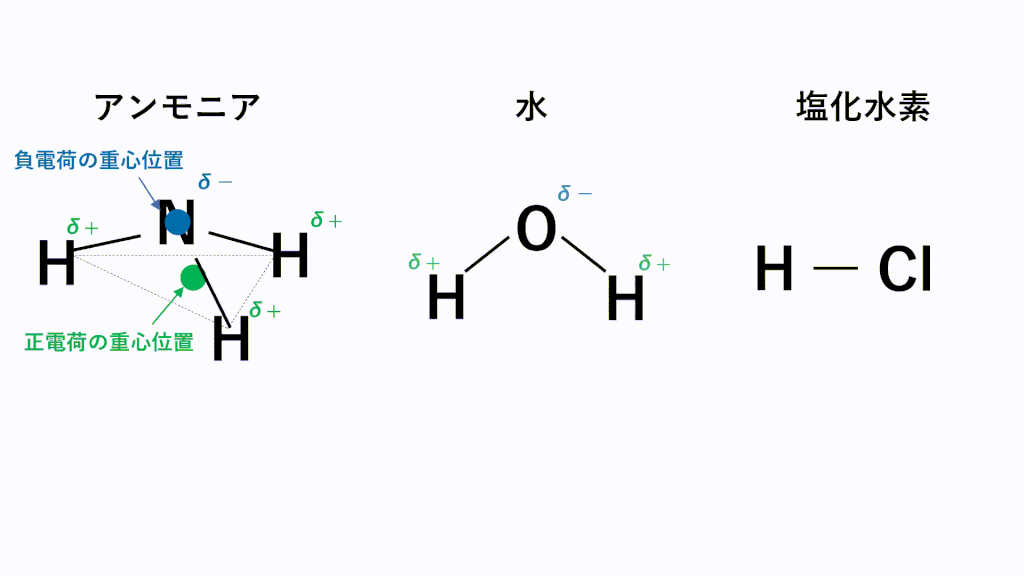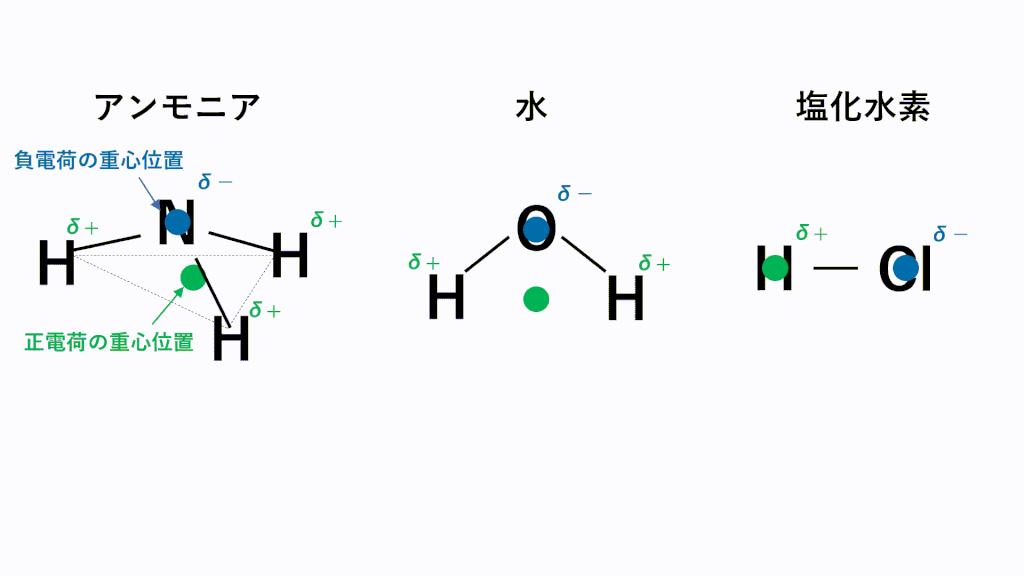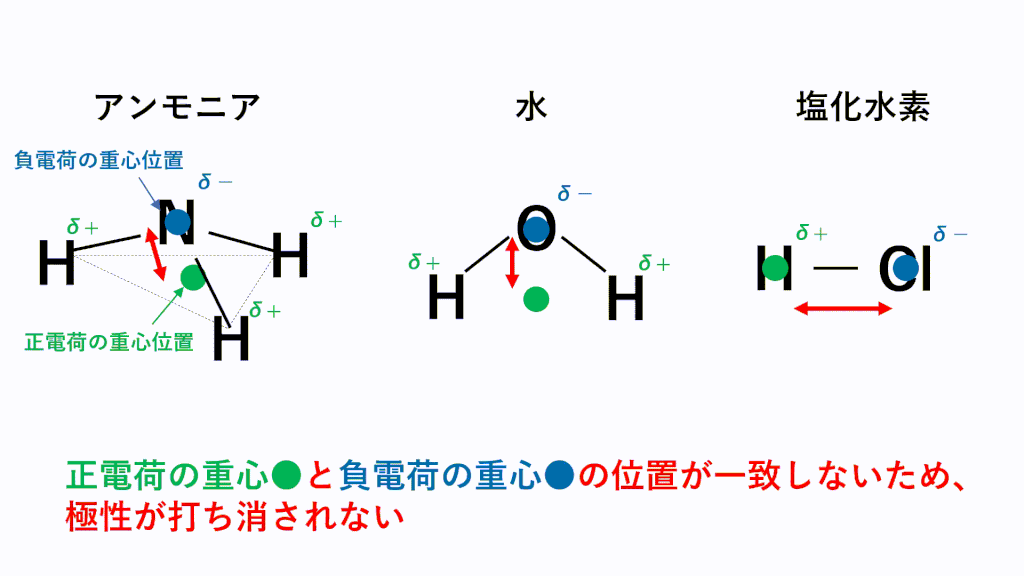
アンモニアでは、N原子のほうがH原子より電気陰性度が高いため、N原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は三角錐なので、負電荷の重心の位置はN原子の位置のままとなり、正電荷の重心は底面の三角形の重心の位置となるため、重心位置が一致せず極性が打ち消されません。
水では、O原子のほうがH原子より電気陰性度が高いため、O原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は折れ線なので、負電荷の重心の位置はO原子の位置のままとなり、正電荷の重心は両端の真ん中の位置となるため、重心位置が一致せず極性が打ち消されません。
塩化水素では、Cl原子のほうがH原子より電気陰性度が高いため、Cl原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は直線なので、負電荷の重心の位置はCl原子の位置のままとなり、正電荷の重心の位置はH原子の位置となるため、重心位置が一致せず極性が打ち消されません。
無極性分子
代表的な例でいうと、無極性分子となるのはメタンCH4,水素化ホウ素BH3,F2などです。
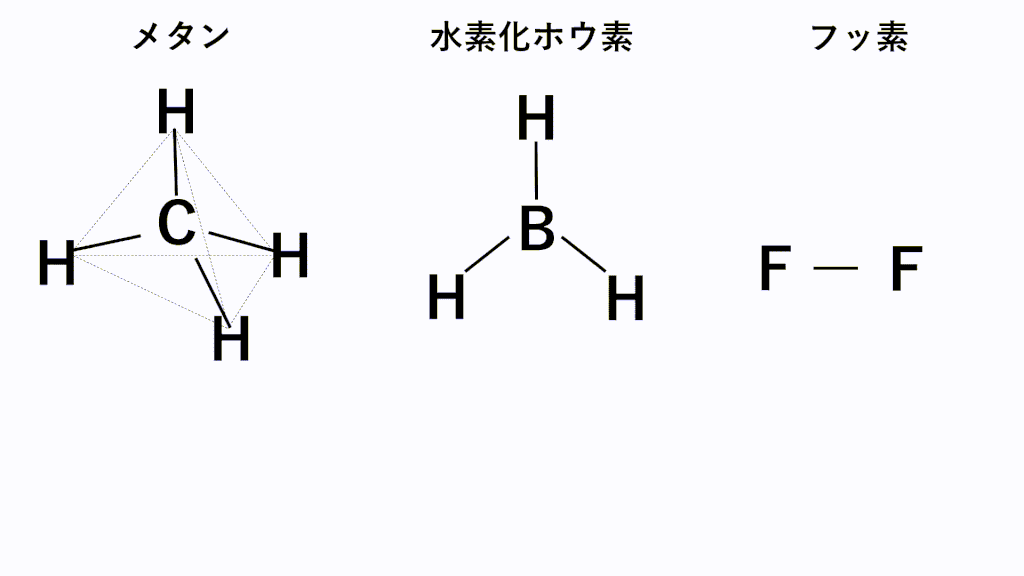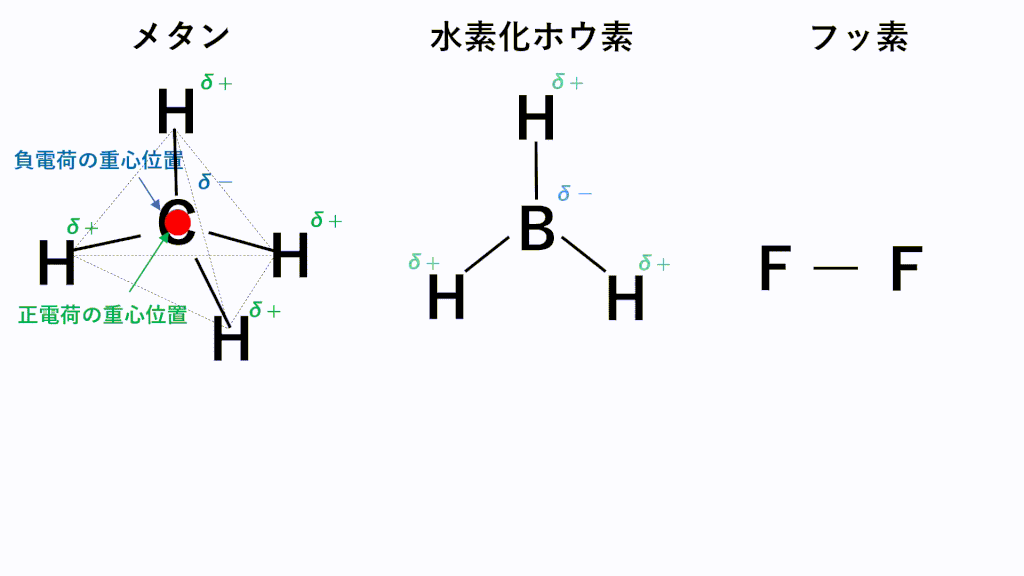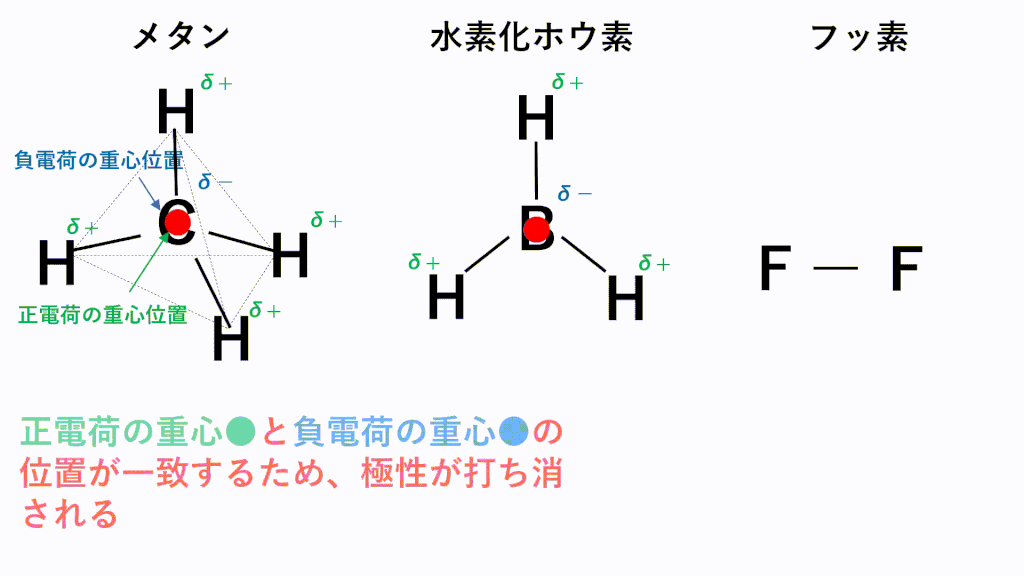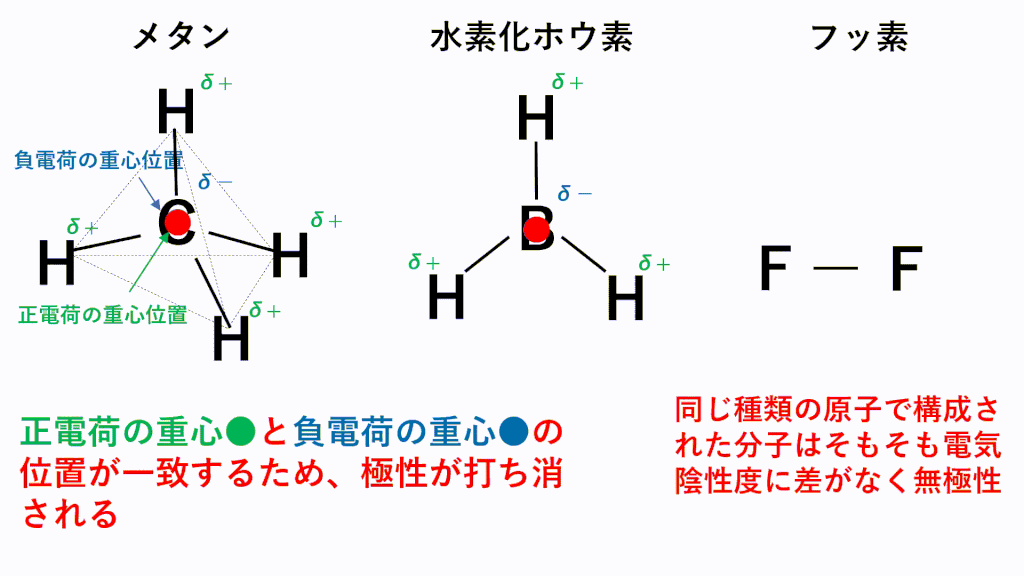
メタンでは、C原子のほうがH原子より電気陰性度が高いため、C原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は正四面体なので、負電荷の重心の位置はC原子の位置のままとなり、正電荷の重心は四面体の重心位置であるC原子の位置と一致するため、極性が打ち消されます。
水素化ホウ素では、B原子のほうがH原子より電気陰性度が高いため、B原子が共有電子対を引き寄せ、負に帯電し、H原子が正に帯電します。また、形は正三角形なので、負電荷の重心の位置はB原子の位置のままとなり、正電荷の重心は正三角形の重心位置であるB原子の位置と一致するため、極性が打ち消されます。
フッ素のように、同じ種類の元素のみからなる分子は電気陰性度に差がないため、極性がそもそもありません。
極性引力とは
極性分子どうしには極性引力という力が働き、引き付けあっています。
例えばHClの場合、Hがδ+,Clがδ-なので、一つのHCl分子中のH(δ+)と隣のHCl分子のCl(δ-)が引き付けあいます。

このようにして極性引力が生じます。
さいごに
極性の考え方は、単に電気陰性度の差で決まっていたわけではないことがわかりましたか?
実際には、電気陰性度の差と、分子の形を考え、正電荷と負電荷の重心が一致しているのか、いないのかで極性分子かどうかが決まっていたのでした。
そのため、みなさんが覚えておかないといけないのは、電子式から分子の形を考えられるようにしておくことと、その結果から極性分子なのかどうかを判断できるようにしておくことです。
とはいえ、本記事で紹介している分子が頻出の分子なので、こちらに掲載している分子について自力で考えられるようになればひとまずOKですので、お気に入りに保存してくりかえし復習してみてください。
なお、復習はタイミングが命なので、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法に記載している復習タイミングも参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。