正塩とは、化学式中に、電離によってH+になることができる酸のHや、OH−になることができる塩基のOHが残っていない塩のことであり、逆に酸性塩や塩基性塩はHやOHが残っている場合の塩のことです。あくまで形式的な分類であって、その塩を溶かした水溶液の液性を示しているわけではありません。液性を考えるためには加水分解を理解しておく必要があります。本記事では、このあたりを詳細に解説していきます。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
塩の種類
正塩とは
正塩とは、化学式中に、電離によってH+になることができる酸のHや、OH−になることができる塩基のOHが残っていない塩のことです。
MgCl2(塩化マグネシウム)、CH3COONa(酢酸ナトリウム)、Na2CO3(炭酸ナトリウム)、(NH4)2SO4(硫酸アンモニウム)など
酸性塩とは
酸性塩とは、化学式中に、電離によってH+になることができる酸のHが残っている塩のことです。
NaHCO3(炭酸水素ナトリウム)、NaHSO4(硫酸水素ナトリウム)、NaH2PO4(リン酸二水素ナトリウム)、Na2HPO4(リン酸一水素ナトリウム)など
正塩のNH4ClやCH3COONaも化学式中にHが含まれていますが、
水溶液中で電離して、NH4+とCl-や、CH3COO-とNa+となるだけで、H+を放出するわけではならないので酸性塩ではありません。
塩基性塩とは
塩基性塩とは、化学式中に、電離によってOH-になることができる塩基のOHが残っている塩のことです。
MgCl(OH)(塩化水酸化マグネシウム)、Cu2CO3(OH)2(炭酸二水酸化二銅(Ⅱ))など
※正塩も酸性塩も塩基性塩も形式的にHやOHを含むかどうかで命名されているだけで、その塩を溶かした水溶液の液性を示しているわけではありません。
塩を溶かした際の水溶液の液性については、以下の加水分解を理解する必要があります。
塩の加水分解の完全攻略
加水分解を考えるうえで、重要なことは、酸や塩基の強弱とは、つまるところどういうことなのかを理解しておくことです。
酸・塩基の強弱についての考え方を忘れた人は【図解】電離度の意味と強酸・強塩基・弱酸・弱塩基と一覧を参考にしてください。
結局のところ、
強酸や強塩基というのは、HCl → H+ + Cl-のように、電離して水素イオンや水酸化物イオンを放出しやすい。
つまり、イオンに分かれた状態が安定的なのが強酸・強塩基ということです。
それに対し、弱酸や弱塩基というのは、CH3COOH → CH3COO-+ H+のように、電離して水素イオンや水酸化物イオンを放出しにくいから弱い。
つまり、分子や化学式のように何かとくっついた形が安定的なのが弱酸・弱塩基ということです。
ちょうど覚えやすいと思います。
精神的に「強い」人は分かれて孤立していても大丈夫ですが、精神的に「弱い」人は何か他の人とくっついているほうが安心するはずです。
そのように擬人化するとイメージがつかみやすく覚えやすいはずです。
このイメージをもとに、加水分解の解説をしていきます。
正塩の加水分解(弱酸と強塩基)
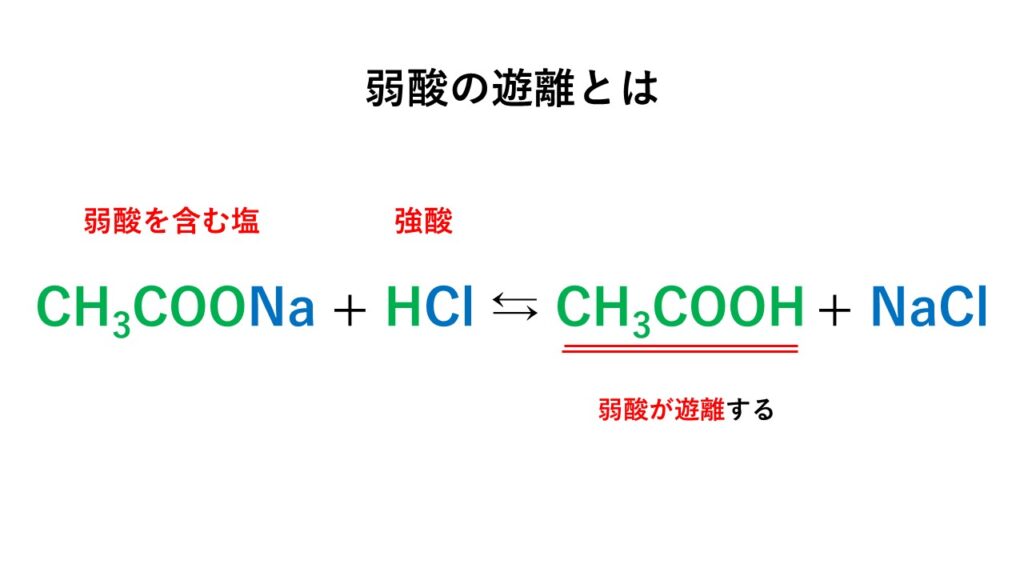
代表例として頻出である酢酸ナトリウムCH3COONaを例にとります。
まずは、酢酸ナトリウムがどのように生成されているかを考えます。
CH3COOH + NaOH → CH3COONa + H2O
弱酸の酢酸と、強塩基の水酸化ナトリウムが中和して生成されるのが酢酸ナトリウムです。
さて、この酢酸ナトリウムは水溶液中で以下のように完全に電離します。
CH3COONa → CH3COO- + Na+
その理由について説明します。
酢酸ナトリウムCH3COONaは、上で述べたように、弱酸である酢酸CH3COOHと強塩基である水酸化ナトリウムを中和させたときに生じる塩です。
弱酸は、くっついておきたいのに対し、強塩基はイオンに分かれたいはずです。
すると、強塩基のせいですべて電離してしまいます。
カップルで例えるとわかりやすいかもしれません。
カップルのうち女性は別れたい、でも男性は付き合っていたい、
という場合、このカップルが付き合ったままで居続けるのは難しく、ほとんどの場合破局するはずです。
同じように、イオンの場合でも「強」酸や「強」塩基とくっついた塩の場合は、いったん完全電離(イオンに分かれる)してしまいます。
そのため、今回の場合、ナトリウムイオンNa+が強塩基であるために完全に電離します。
では次に、完全電離したあとについてです。
ナトリウムイオンNa+は完全電離できたので、これで安定になりました。
しかし、弱酸のイオンである酢酸イオンCH3COO-は何かとくっつきたい性質があるため、不安定な状態です。
しかし、この溶液にはナトリウムイオンNa+の他に陽イオンはありません。周りにいるのは、溶媒である水H2Oだけです。
水H2Oは、水溶液中では
H2O → H+ + OH-
とわずかながら電離しています。
そのため、酢酸イオンCH3COO-は水H2Oから生じる一部のH+とくっつくのです。
結果として、以下の反応が起こります。
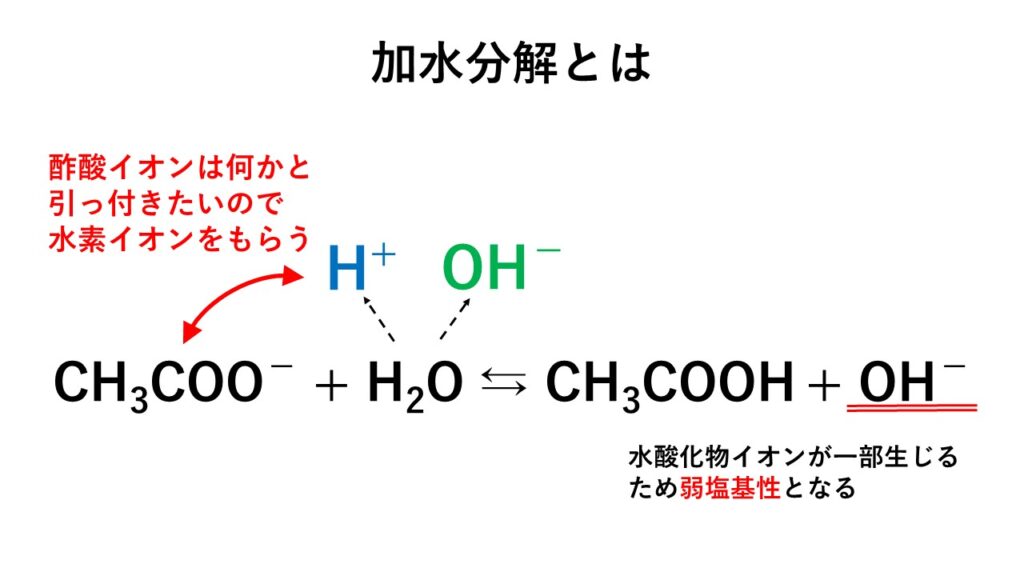
酢酸イオンに水素イオンを奪われた水酸化物イオンは独りぼっちになってしまうので、
弱塩基性を示します。
これが加水分解の仕組みです。
その結果、
弱酸と強塩基の中和の際、中性にはならずに、弱塩基性を示すことになります。
具体的には、酢酸と水酸化ナトリウムが中和したときは、酢酸ナトリウムの塩を生成するため、加水分解が起こり、水溶液は弱塩基性を示します。(中和 = 中性ではないということです!)
CH3COOH + NaOH → CH3COONa + H2O
正塩の加水分解(強酸と弱塩基)
代表例として頻出である塩化アンモニウムNH4Clを例にとります。
まずは、塩化アンモニウムがどのように生成されているかを考えます。
NH3 + HCl → NH4Cl
弱塩基のアンモニア水溶液と、強酸の塩酸が中和して生成されるのが塩化アンモニウムです。
さて、この塩化アンモニウムは水溶液中で以下のように完全に電離します。
NH4Cl → NH4+ + Cl+
その理由について説明します。
塩化アンモニウムNH4Clは、上で述べたように、弱塩基であるアンモニアNH3と強酸である塩酸HClを中和させたときに生じる塩です。
弱塩基は、くっついておきたいのに対し、強酸はイオンに分かれたいはずです。
すると、強酸のせいですべて電離してしまいます。
酢酸ナトリウムのときと同様にカップルで例えると、
アンモニウムイオンNH4+は弱塩基なので誰かとくっついていたいのに対し、塩化物イオンCl-が強酸であるために誰ともくっつきたくない、離れていたい、という性質なので、塩化物イオンのせいで完全に電離します。
そして完全電離したあと、
塩化物イオンCl-は完全電離できたので、これで安定になりました。
しかし、弱塩基のイオンであるアンモニウムイオンNH4+は何かとくっつきたい性質があるため、不安定な状態です。
しかし、この溶液には塩化物イオンCl-の他に陰イオンはありません。周りにいるのは、溶媒である水H2Oだけです。
水H2Oは、水溶液中では
H2O → H+ + OH-
とわずかながら電離しているため、アンモニウムイオンNH4+は水H2Oから生じる一部のOH-とくっつき、
結果として、以下の反応が起こります。
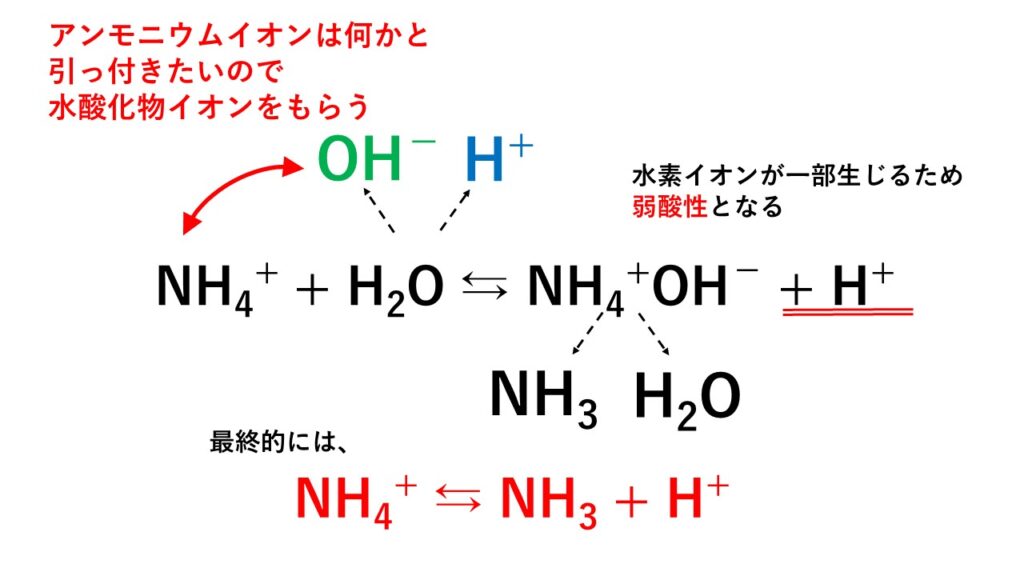
アンモニウムイオンに水酸化物イオンを奪われた水素イオンは独りぼっちになってしまうので、弱酸性を示します。
その結果、
強酸と弱塩基の中和の際、中性にはならずに、弱酸性を示すことになります。
具体的には、塩酸とアンモニアが中和したときは、塩化アンモニウムの塩を生成するため、加水分解が起こり、水溶液は弱酸性を示します。
NH3 + H2O → NH4Cl + H2O
酸性塩の加水分解(弱酸と強塩基)
代表例として頻出である炭酸水素ナトリウムNaHCO3を例にとります。
まずは、炭酸水素ナトリウムがどのように生成されているかを考えます。
H2CO3 + NaOH → NaHCO3 + H2O
弱酸の炭酸水溶液と、強塩基の水酸化ナトリウムが反応して(完全に中和ではない)生成されるのが炭酸水素ナトリウムです。
さて、この炭酸水素ナトリウムは水溶液中で以下のように完全に電離します。
NaHCO3 → Na+ + HCO3-
その理由について説明します。
炭酸水素ナトリウムNaHCO3は、上で述べたように、弱酸である炭酸H2CO3と強塩基である水酸化ナトリウムNaOHを反応させたときに生じる塩です。
弱酸は、くっついておきたいのに対し、強塩基はイオンに分かれたいはずです。
すると、強塩基のせいですべて電離してしまいます。
これまでと同様にカップルで例えると、
炭酸水素イオンHCO3-は弱酸なので誰かとくっついていたいのに対し、ナトリウムイオンNa+が強塩基であるために誰ともくっつきたくない、離れていたい、という性質なので、ナトリウムイオンのせいで完全に電離します。
そして完全電離したあと、
ナトリウムイオンNa+は完全電離できたので、これで安定になりました。
しかし、弱酸のイオンである炭酸水素イオンHCO3-は何かとくっつきたい性質があるため、不安定な状態です。
しかし、この溶液にはナトリウムイオンNa+の他に陽イオンはありません。周りにいるのは、溶媒である水H2Oだけです。
水H2Oは、水溶液中では
H2O → H+ + OH-
とわずかながら電離しているため、炭酸水素イオンHCO3-は水H2Oから生じる一部のH+とくっつき、
結果として、以下の反応が起こります。
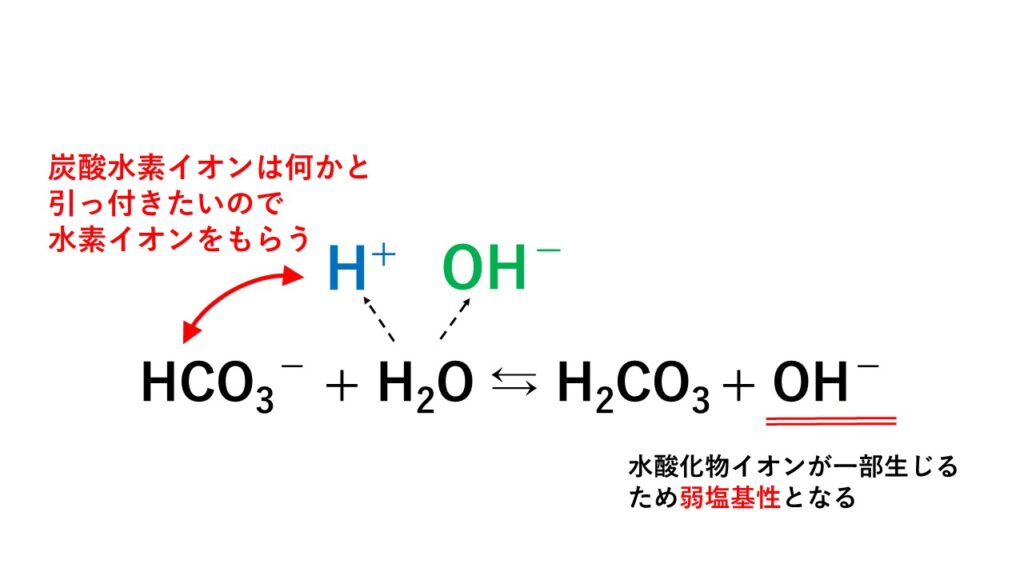
炭酸水素イオンに水素イオンを奪われた水酸化物イオンは独りぼっちになってしまうので、弱塩基性を示します。
酸性塩の加水分解(強酸と強塩基)
代表例として頻出である硫酸水素ナトリウムNaHSO4を例にとります。
まずは、硫酸水素ナトリウムがどのように生成されているかを考えます。
H2SO4 + NaOH → NaHSO4 + H2O
強酸の硫酸水溶液と、強塩基の水酸化ナトリウムが反応して(完全に中和ではない)生成されるのが硫酸水素ナトリウムです。
さて、この硫酸水素ナトリウムは水溶液中で以下のように完全に電離します。
NaHSO4 → Na+ + HSO4-
その理由について説明します。
硫酸水素ナトリウムNaHSO4は、上で述べたように、強酸である硫酸H2SO3と強塩基である水酸化ナトリウムNaOHを反応させたときに生じる塩です。
今回は、強酸、強塩基どちらもイオンに分かれたいはずです。
これまでと同様にカップルで例えると、
どちらも別れたいので合意のうえですべて電離してしまいます。
具体的には、硫酸水素イオンHSO4-もナトリウムイオンNa+も強塩基であるために誰ともくっつきたくない、離れていたい、という性質なので、どちらも別れたがっているので、お互いの合意のもと完全に電離します。
そして完全電離したあと、
ナトリウムイオンNa+は完全電離できたので、これで安定になりました。
しかし、強酸のイオンである硫酸水素イオンHSO4-はさらに電離したい性質があるため、不安定な状態です。
結果として、以下の反応が起こります。
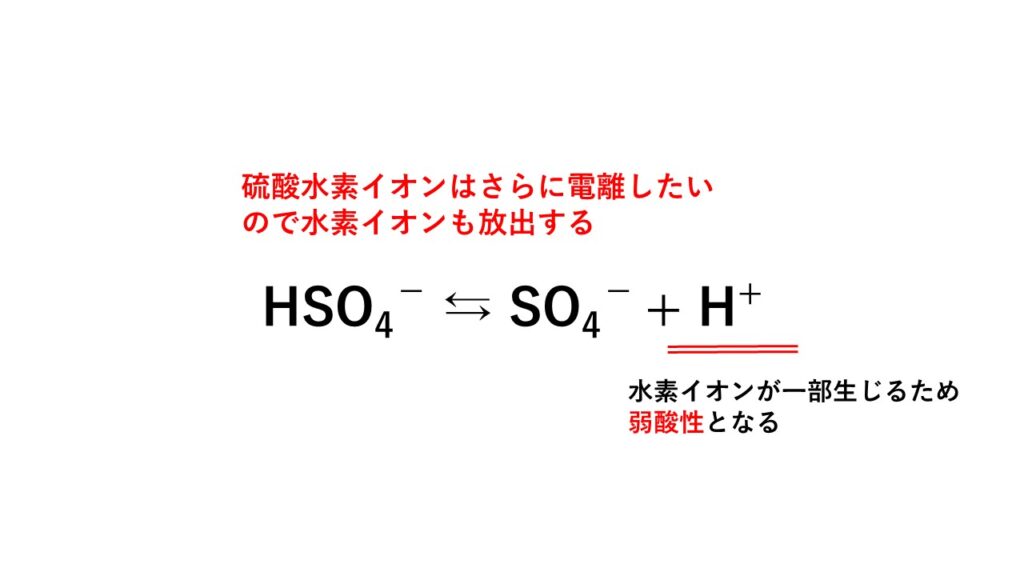
硫酸水素イオンがさらに放出してしまった水素イオンにより、弱酸性を示します。
さいごに
化学基礎範囲での塩の加水分解について解説しました。化学発展のほうでは、これに加えて計算問題も出題されます。いずれにせよまずは基本の理解が重要ですので、自分で説明できるレベルまで繰り返し復習しておきましょう。
なお、復習はタイミングが命です。僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法に復習のタイミングについて記載していますので、参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。