そもそも第nイオン化エネルギーの意味を理解していますか?本記事では、第nイオン化エネルギーの意味、そして入試に出る「イオン化エネルギーが急激に大きくなるときがいつか」についての考え方を解説し、さらに一瞬で答えられるようになる方法を具体的かつ丁寧に解説したうえで、練習問題を提示します。もちろん解説付きです。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
第nイオン化エネルギーとは
これまで説明してきたように、第一イオン化エネルギーは原子から1コの電子を取り去り1価の陽イオンにするために必要なエネルギーです。
第二イオン化エネルギーは一価の陽イオンからさらに電子をもう1コ取り去り2価の陽イオンにするために必要なエネルギー、
第三イオン化エネルギーは2価の陽イオンからさらに1コ電子を取り去り3価の陽イオンにするために必要なエネルギーです。
つまり、
A→A+→A2+→A3+→…
と次々と電子を引き離していくときの各段階で必要なエネルギーを第nイオン化エネルギーといいます。
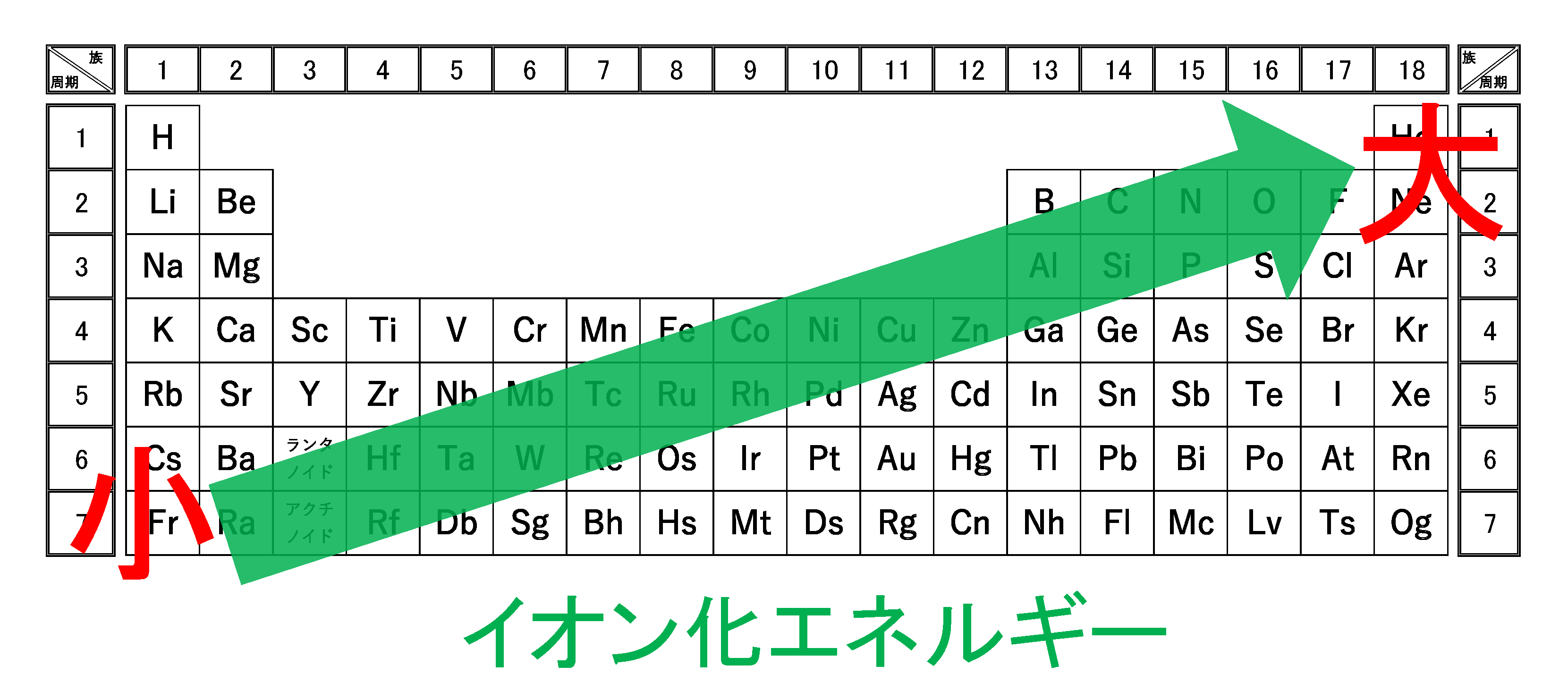
一般に希ガスと同じ電子配置の状態の原子またはイオンから電子を取り去るとき,第nイオン化エネルギーは急激に増加します。これがよく出題されます。
なぜなら、希ガスと同じ電子配置は閉殻またはオクテットで非常に安定的なので、電子を取り去るには莫大なエネルギーを要するからです。
具体例で考えてみましょう。
Naの第nイオン化エネルギー
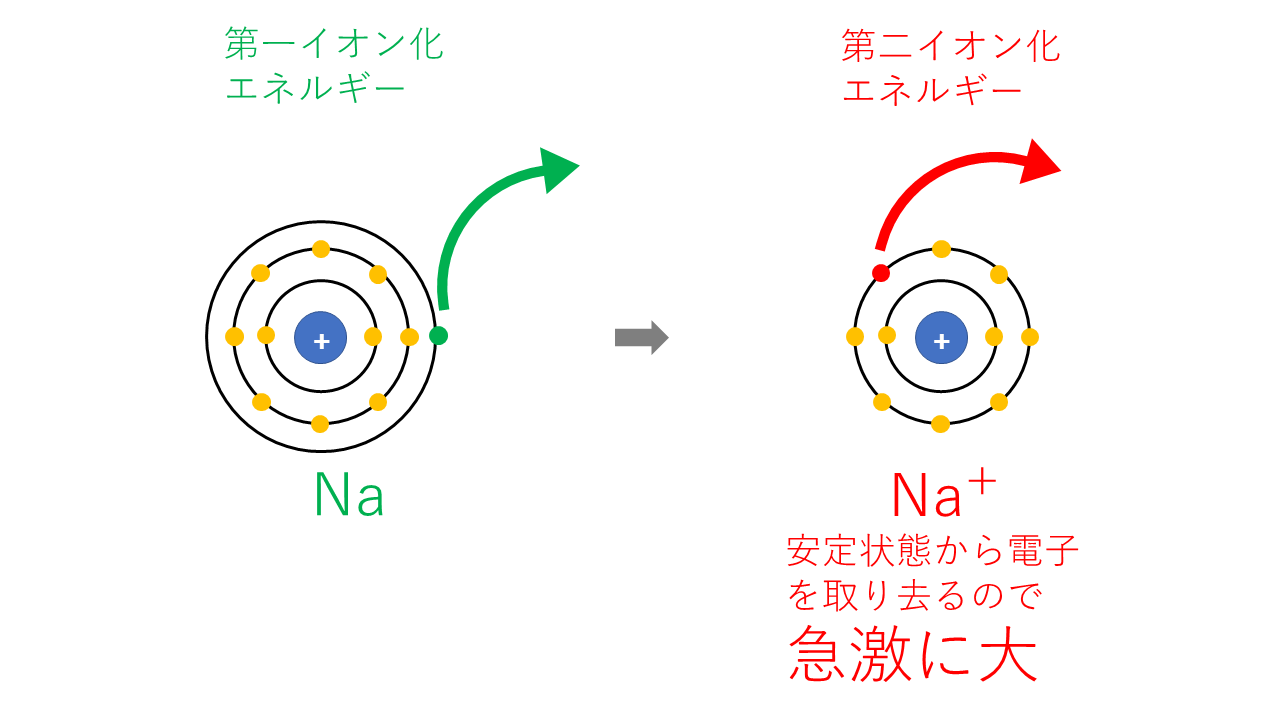
| 第一イオン化エネルギー | 電子11個のNaから電子1個を取り去る |
| 第二イオン化エネルギー | 電子10個のNa+から電子1個を取り去りますが、Neと同じ電子配置で安定な状態から電子を取るのはかなり大変なので、第一イオン化エネルギーに比べ急激に大きくなります。 |
Mgの第nイオン化エネルギー
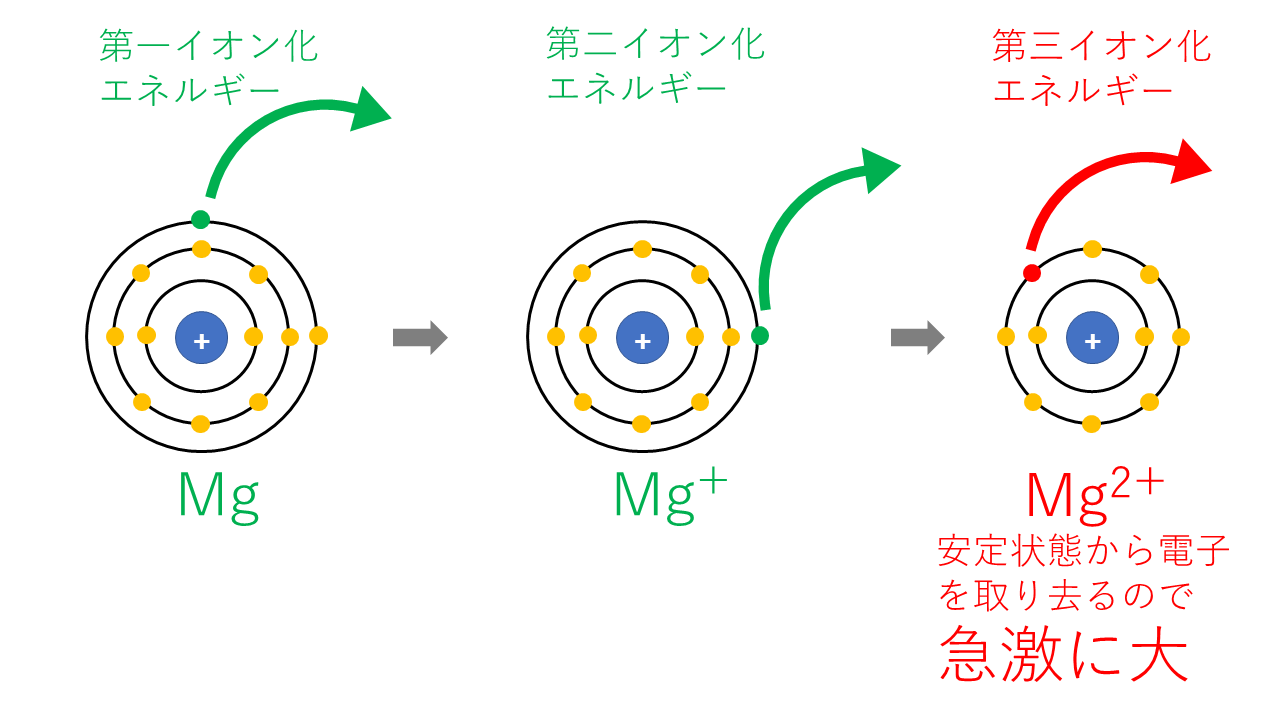
| 第一イオン化エネルギー | 電子12個のMgから電子1個を取り去る |
| 第二イオン化エネルギー | 電子11個のMg+(Naと同じ電子配置)から電子1個を取り去る |
| 第三イオン化エネルギー | 電子10個のMg2+から電子1個を取り去りますが、Neと同じ電子配置で安定な状態から電子を取るのはかなり大変なので、第二イオン化エネルギーに比べ急激に大きくなります。 |
Alの第nイオン化エネルギー
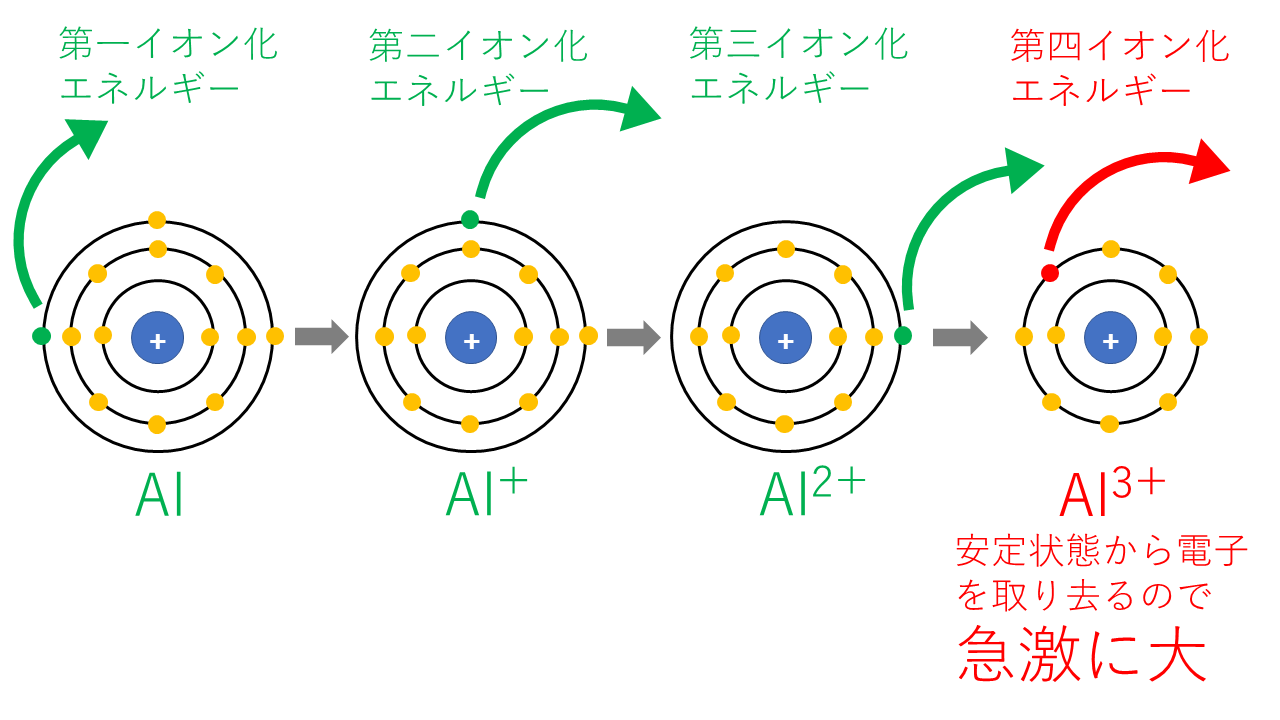
| 第一イオン化エネルギー | 電子13個のAlから電子1個を取り去る |
| 第二イオン化エネルギー | 電子12個のAl+(Mgと同じ電子配置)から電子1個を取り去る |
| 第三イオン化エネルギー | 電子11個のAl2+(Naと同じ電子配置)から電子1個を取り去る |
| 第四イオン化エネルギー | 電子10個のAl3+から電子1個を取り去りますが、Neと同じ電子配置で安定な状態から電子を取るのはかなり大変なので、第三イオン化エネルギーに比べ急激に大きくなります。 |
第nイオン化エネルギーの攻略法
「第何イオン化エネルギーで急激に大きくなるのか」が入試ではよく聞かれます。
これまで見てきたように、
NaならNa+から電子を奪う第二イオン化エネルギー
MgならMg2+から第三イオン化エネルギー
AlならAl3+から電子を奪う第四イオン化エネルギー
が急激に大きくなるところです。
つまり、その原子の第(価数+1)イオン化エネルギーで急激に大きくなります。
もしCやNなど14族以上の典型元素が出題された場合、第(族番号の下一桁+1)イオン化エネルギーで急激に大きくなります。
練習問題
(1)カリウムは第一イオン化エネルギーと第二イオン化エネルギーではどちらが大きいか。
(2)カルシウムの第一イオン化エネルギーと第二イオン化エネルギーと第三イオン化エネルギーで最も大きいのはどれか。
[su_spoiler title=”解答解説※タップで表示” style=”fancy”]【解答】
(1)第二イオン化エネルギー
(2)第三イオン化エネルギー
【解説】
(1)カリウムはイオンになると、K+で表されるため、価数は1です。そのため、価数に1を加えた第2イオン化エネルギーで急激に大きくなるはずです。なぜなら、これまで解説してきたとおり、K+の状態がアルゴン(希ガス)と同じ電子配置で最も安定していて、その状態から電子をさらにとるのは膨大なエネルギーが必要だからです。
(2)カルシウムはイオンになると、Ca2+で表されるため、価数は2です。そのため、価数に1を加えた第3イオン化エネルギーで急激に大きくなるはずです。なぜなら、これまで解説してきたとおり、Ca2+の状態がアルゴン(希ガス)と同じ電子配置で最も安定していて、その状態から電子をさらにとるのは膨大なエネルギーが必要だからです。
[/su_spoiler]イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径について
根本的な考え方が同じである「イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径」についての他記事は以下を参照ください。
さいごに
第nイオン化エネルギーは、規則性があるので判断しやすい分、本記事を読んだあとにすぐに問題演習をすると丸暗記みたいになってしまう点に気を付けてください。
ちゃんと本記事の内容を自分で説明できるようになっておかないと、真の理解とはいえず、すぐに忘れてしまいます。必ず自分で説明できるレベルになるようくりかえし復習してください。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。