水は共有結合の化合物で、イオン結合の化合物と異なり、イオンに分かれません。しかし、水の場合は例外的にごくわずかの水素イオンと水酸イオンとに電離します。水のイオン積とは水溶液中での水素イオン濃度と水酸化物イオン濃度の積のことです。本記事では、水のイオン積を用いた、水素イオン濃度や水酸化物イオン濃度の計算法、pHとpOHの計算法について練習問題とともにわかりやすく解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
水のイオン積
水はわずかに電離して水素イオンH+と水酸化物イオンOH-を生じています。
H2O ⇄ H+ + OH-
25℃で水の電離度は極めて小さいので、電離している水分子はごく僅かです。
H+とOH-のモル濃度はそれぞれ水素イオン濃度、水酸化物イオン濃度と呼ばれ、[H+]、[OH-]と表されます。
この式は25℃であればすべての水溶液中で成り立ちます。
純粋な水の場合、水分子からはH+とOH-が等量生じるので水中のH+とOH-のモル濃度は等しくなります。
このため、25℃の純粋な水では[H+]=[OH-]=1.0×10-7mol/Lずつ存在するということです。
しかし、この水のイオン積は、純粋な水以外でも成り立ちます。
塩酸だろうが硫酸だろうがアンモニア水だろうが水酸化ナトリウム水溶液だろうが、H2Oさえ含まれていれば、どんな溶液でも成り立ちます。
酸性の溶液では、H+が多く、塩基性ではOH-が多いことから、以下が成り立ちます。
- 酸性 [H+] >1.0×10-7mol/L > [OH-]
- 中性 [H+] = 1.0×10-7mol/L = [OH-]
- 塩基性 [H+] < 1.0×10-7mol/L < [OH-]
酸の水素イオン濃度と塩基の水酸化物イオン濃度
ここで、酸から生じる水素イオン濃度と、塩基から生じる水酸化物イオン濃度の計算法を紹介します。
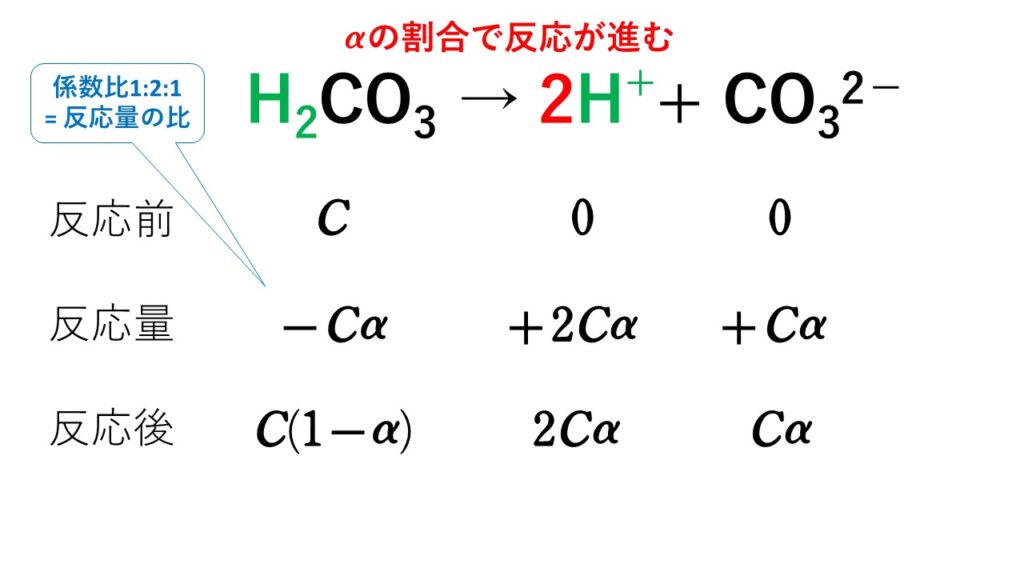
塩基の[OH-] = nCα
※ただし、nは価数、Cはモル濃度、αは電離度。(強酸・強塩基の場合電離度α=1)
例題1
(1)0.25mol/Lの硫酸の水素イオン濃度はいくらか。
(2)0.10mol/Lの酢酸(電離度0.014)の水素イオン濃度はいくらか。
(3)0.050mol/Lの水酸化バリウム水溶液の水酸化物イオン濃度はいくらか。
(4)0.10mol/Lのアンモニア水溶液(電離度0.013)の水酸化物イオン濃度はいくらか。
[su_spoiler title=”【解答解説】※タップで表示” style=”fancy”]【解答解説】
強酸や強塩基の電離度は1とみなしてよい、というのがルールです。
(1)硫酸は価数2の強酸なので、[H+] = 2×0.25×1 = 0.50mol/L
(2)酢酸は価数1の弱酸なので、[H+] = 1×0.10×0.014 = 1.4×10-3mol/L
(3)水酸化バリウムは価数2の強塩基なので、[OH-] = 2×0.050×1 = 0.10mol/L
(4)アンモニアは価数1の弱塩基なので、[OH-] = 1×0.10×0.013 = 1.3×10-3mol/L
[/su_spoiler]さいごに
pH計算の基本となる項目ですので、しっかりと復習しましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。