おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
電子殻(K殻,L殻,M殻,N殻…)
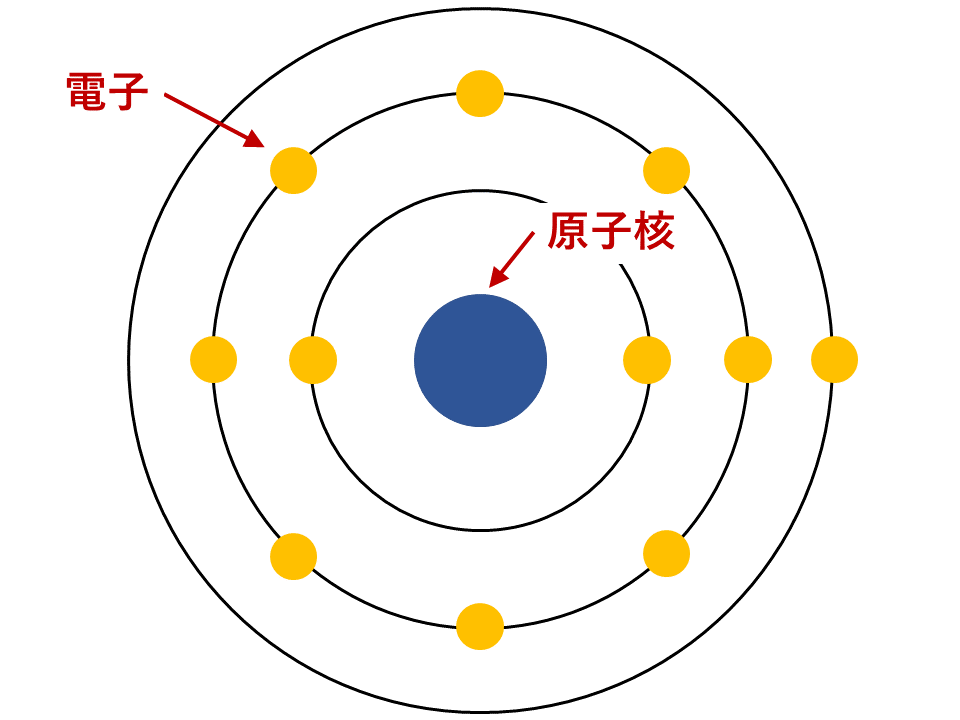
化学|原子・分子・元素の違いと陽子・中性子・質量数・原子番号など でも解説したように、原子内では,原子核のまわりを原子番号に等しい数の電子が高速でまわっています。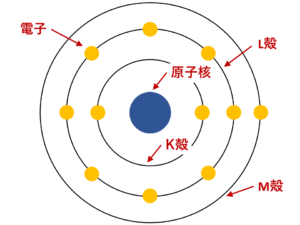 これらの電子は,一定個数がグループをつくり,原子核のまわりをいくつかの軌道に分かれて運動しています。この軌道の集まりを電子殻といいいます。
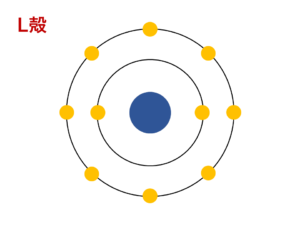
電子殻は原子核に近いものから順にK殻,L殻,M殻,N殻,…とよばれます。
各電子殻に収容できる電子の最大数は,K殻から順に2,8,18,32個,…と決まっています。
一般に,
内側からn番目の電子殻には最大2n2個の電子が収容されます。
これらの電子は,一定個数がグループをつくり,原子核のまわりをいくつかの軌道に分かれて運動しています。この軌道の集まりを電子殻といいいます。
電子殻は原子核に近いものから順にK殻,L殻,M殻,N殻,…とよばれます。
各電子殻に収容できる電子の最大数は,K殻から順に2,8,18,32個,…と決まっています。
一般に,
内側からn番目の電子殻には最大2n2個の電子が収容されます。
なぜK殻から始まるのか、その理由
ちなみに、なぜK,L,M,Nとアルファベット順なのにAから始まらないのでしょうか。(もちろんこんなことテストには出ません) 結論は、さらに内側の電子殻が発見された時のために、10個(A殻~J殻)ほどは余裕を残しておく必要があったから。 電子が飛び回る「電子殻」というのが発見された当時、その段階で一番内側のものを「A殻」と名付けてしまうと、それ以降にもしもさらに内側の電子殻が発見されてしまうと名称がややこしくなってしまう、とその当時の学者が考えたからです。 結局のところ、K殻よりも内側の電子殻は発見されていませんので、「A殻」と名付けていても問題なかったのでした。ですが、今更変えると余計に混乱が生じるため現行のままとなっています。電子配置
電子配置の基本ルール①電子は,原則として内側の電子殻から外側の電子殻へと配置されていく。
②最外殻電子は最大でも8個までしか収容されない。
※最外殻電子(=最も外側の電子殻に存在する電子)
基本的には上記2つの原則に従います。
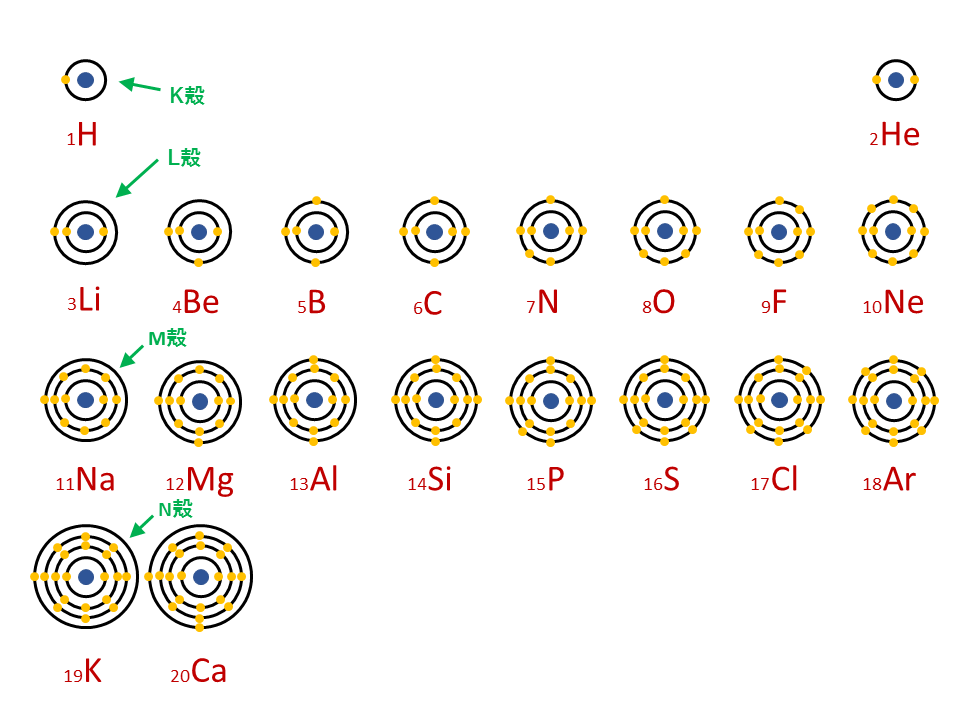
原子番号1番のH(水素)から20番のCa(カルシウム)までの電子配置を以下に示します。
 考え方を具体的に説明します。
考え方を具体的に説明します。
例1)原子番号7番のN(窒素)の電子配置
窒素の原子番号は7なので、持っている電子の数は7個です。 STEP1 基本ルール①より、まずは最も内側のK殻に電子が入ります。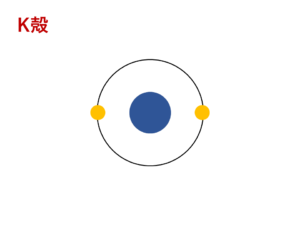 K殻に入れることができる電子は2個までです。
STEP2
次に、1つ外側のL殻に5個の電子が入ります。
K殻に入れることができる電子は2個までです。
STEP2
次に、1つ外側のL殻に5個の電子が入ります。
-300x225.png) これで窒素の持つ7個の電子全てが収まったので完成です。
これで窒素の持つ7個の電子全てが収まったので完成です。
例1)原子番号20番のCa(カルシウム)の電子配置
カルシウムの原子番号は20なので、持っている電子の数は20個です。 STEP1 基本ルール①より、まずは最も内側のK殻に電子が入る。 K殻に入れることができる電子は2個までです。
STEP2
次に、1つ外側のL殻に8個の電子が入ります。
K殻に入れることができる電子は2個までです。
STEP2
次に、1つ外側のL殻に8個の電子が入ります。
 L殻に入れることができる電子は8個までです。
STEP3
次に、1つ外側のM殻に8個の電子が入ります。
L殻に入れることができる電子は8個までです。
STEP3
次に、1つ外側のM殻に8個の電子が入ります。
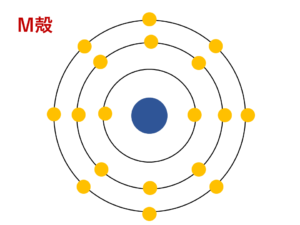 本来M殻は18個まで電子が入りますが、電子配置のルール②より最外殻電子は8個までしか入らないので次の殻にいきます。
STEP4
N殻に2個の電子が入ります。
本来M殻は18個まで電子が入りますが、電子配置のルール②より最外殻電子は8個までしか入らないので次の殻にいきます。
STEP4
N殻に2個の電子が入ります。
-300x225.png) これでカルシウムの持つ20個の電子全てが収まったので完成です。
これでカルシウムの持つ20個の電子全てが収まったので完成です。
電子配置の一覧
電子配置はこのような手順で考えます。 原子番号1番のH(水素)から20番のCa(カルシウム)までの電子配置を以下に示します。 そして、各電子殻が最大数の電子で満たされた状態を閉殻といい,このとき原子は非常に安定な
状態となります。
ArではM殻(定員18個)に8個の電子が入った状態となります。
このときの状態も閉殻と同じように安定で,この状態をオクテットであるといいます。
つまり、周期表の一番右に該当する「希ガス(He,Ne,Ar,…)」は安定的で、他の原子と反応しません。
そして、各電子殻が最大数の電子で満たされた状態を閉殻といい,このとき原子は非常に安定な
状態となります。
ArではM殻(定員18個)に8個の電子が入った状態となります。
このときの状態も閉殻と同じように安定で,この状態をオクテットであるといいます。
つまり、周期表の一番右に該当する「希ガス(He,Ne,Ar,…)」は安定的で、他の原子と反応しません。

.png)