【図解】電子親和力とは、陰イオンにするときに放出されるエネルギーのことです。本記事では電子親和力を考えるうえで基礎となる、定義の考え方と覚え方、周期表では右上が最大となる理由について具体的かつ丁寧に解説します。そして、なぜ電子親和力はハロゲンが最大で希ガスが最小となるかについても解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
電子親和力とは
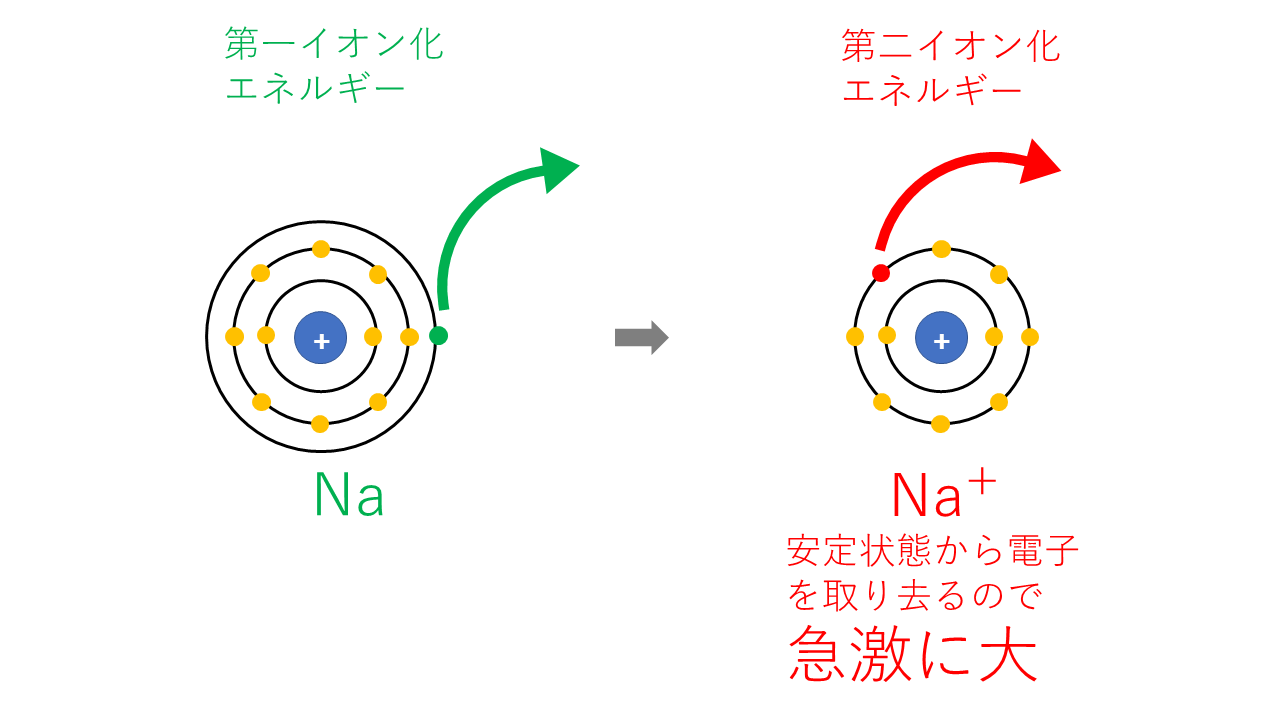
「原子が電子を一つ得て一価の陰イオンになるときに放出されるエネルギー」です。
出典:http://chemwiki.ucdavis.edu/
そしてその大きさは、希ガスを除き、周期表の「右上」のほうが大きく、「左下」が小さくなります。
周期表の「右上」が大きいという点については、イオン化エネルギーと共通です。
イオン化エネルギーのときと同様、「電子の引きつけ度合い」と理解しておくと、その理由がわかります。
イオン化エネルギーの考え方を忘れた人は【図解】イオン化エネルギーの定義と大小関係の考え方とその理由をわかりやすく解説
それでは、細かく見ていきましょう。
電子親和力でエネルギーが放出される、ってどういうこと?
電子親和力とは「原子が電子を一つ得て一価の陰イオンになるときに放出されるエネルギー」です。
つまり、電子を引き離すイオン化エネルギーと反対で、原子に電子をくっつけるときの話です。
エネルギー放出のイメージが掴みにくいので、まずは例え話から始めます。
例えば、隕石が星の引力(重力)に引きつけられて衝突すると、爆風や熱・光・音などが発生します。
この熱や光や爆風などがエネルギーの一種です。

わかりますか?隕石は地球などの星に重力で引き付けられるため、極論、放っておいても衝突します。
それでは、電子はどうか。
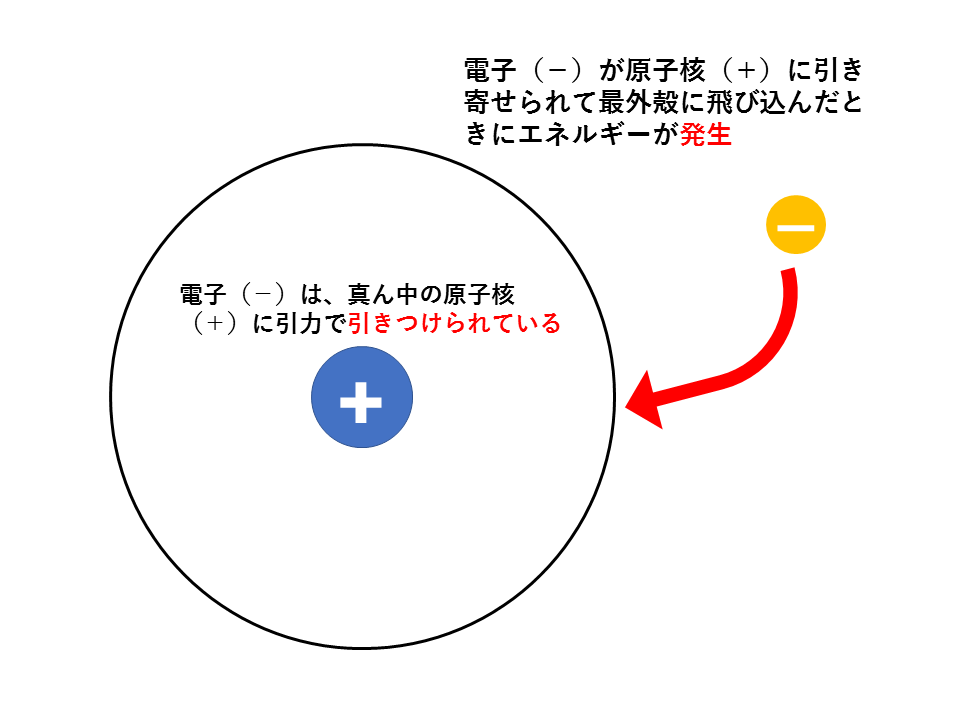
原子核には陽子(+)が含まれているため、引力(静電気力)により電子(-)は原子核に引き付けられているため、極論、放っておいても原子核に衝突します。
そのため、電子が最外殻に飛び込んだときには、先ほどの隕石の場合と同じようにエネルギーが発生するはずです。この発生するエネルギーが電子親和力です。
電子親和力は電子の引きつけ度合い
軽い星より重たい星のほうが重力が強いことはご存知でしょうか?
星が重たく、隕石を引き寄せる力が強いほど、隕石はより速く激しく星に衝突し、発生するエネルギー(爆風や熱・光・音など)はより大きくなります。
これは電子親和力に関しても同じことが言えます。
つまり、原子核(+)が電子を引き付ける引力が強いほど、陰イオンになるときにはたくさんのエネルギーが放出されるということになります。
このため、電子親和力が大きい原子は、イオン化エネルギーと同様で電子を引き付ける引力が強いのです。
電子親和力は同一周期ではハロゲンが最大
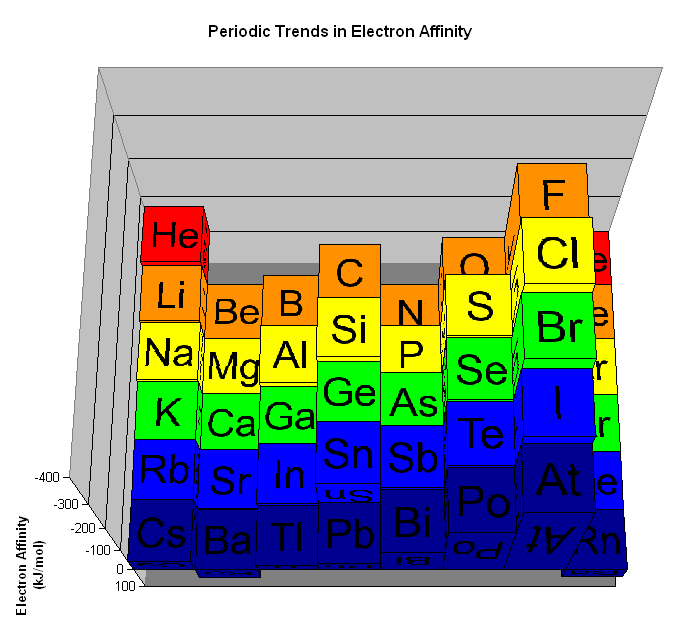
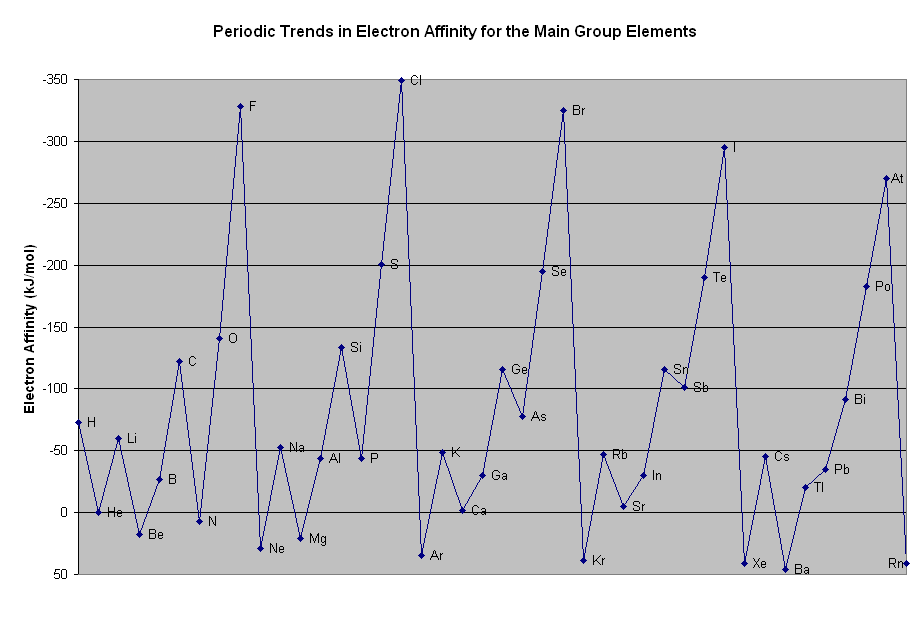
イオン化エネルギーと同じく、電子を引きつける引力が強いほど電子親和力が大きいのにも関わらず、以下のように電子親和力の大きさは全体的にボコボコしています。(イオン化エネルギーのように右上が大きいとは言えません。)この原因は、電子同士の相互作用が影響しており、高校レベルでは解説不可能です。
そのため、同一周期における電子親和力の最大が何かを押さえておけば大丈夫です。

出典:http://chemwiki.ucdavis.edu/
同一周期(横)についての考察
例えば、周期表の第2周期(Li~Ne)をもとに説明していきます。
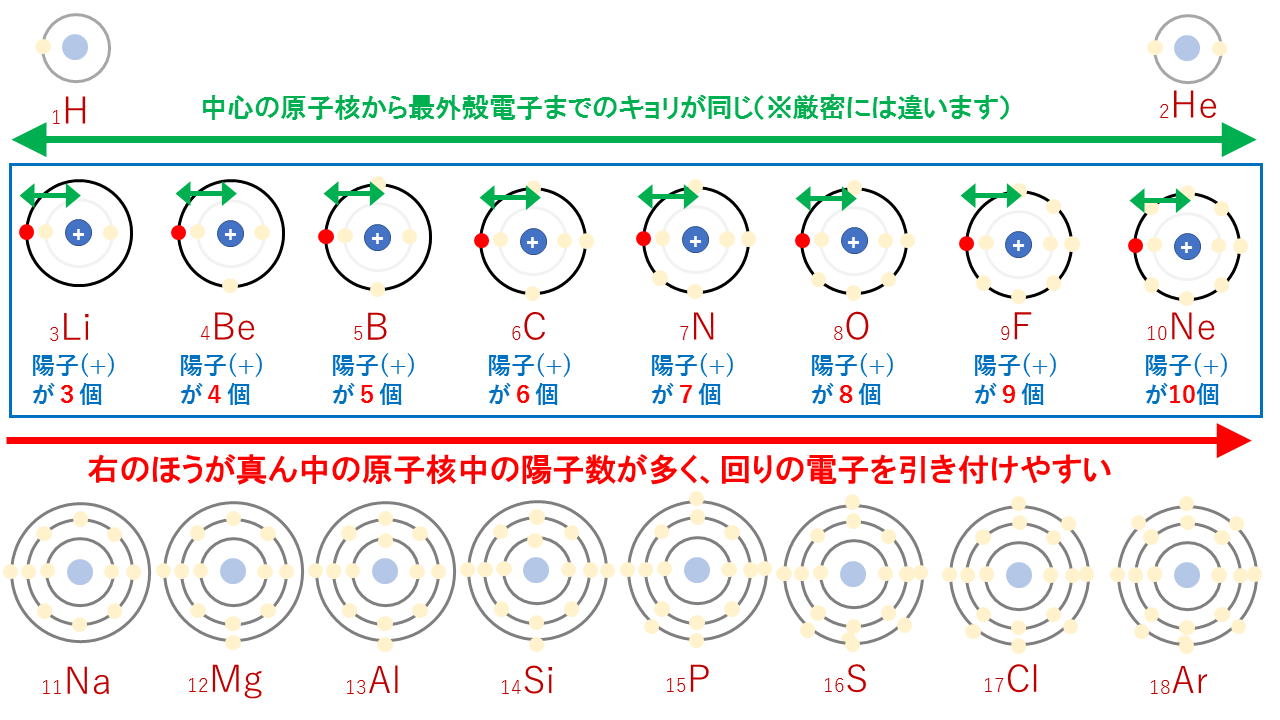
第2周期の最外殻はすべてL殻であり、真ん中にある原子核からの距離がどの原子でも同じです。※本当は違います。詳しくは原子半径(原子の大きさ)の周期表での大小関係とその理由を参照。
では何が違うのかというと、真ん中の原子核内にある陽子(+)の個数が違います。
真ん中の原子核内にある陽子(+)が多いほど、回りの電子を引き付けやすいはずです。つまり、周期表の右側の方が原子番号が大きく、陽子数が多いため、電子を引き付ける強さが強くなります。そのため、右側の方が電子が引き寄せられやすく大きなエネルギーが発生します。
よって、周期表の右側の方が電子親和力が大きいのです。
しかしイオン化エネルギーと違い、電子親和力は一番右の希ガスが最大とはなりません。
その理由を解説していきます。
電子親和力はハロゲンが最大で希ガスがむしろ最小となる理由
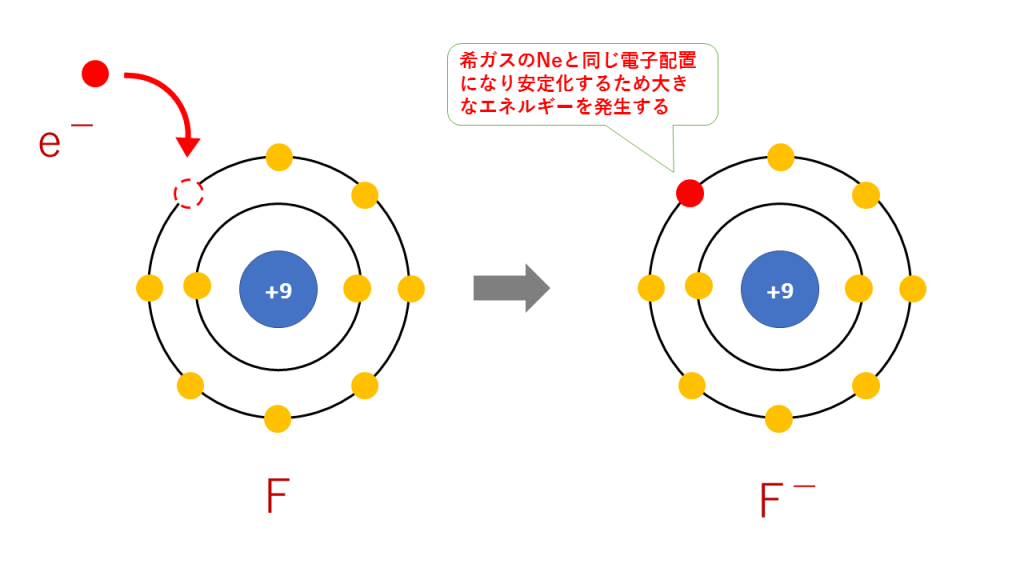
上記の説明から、周期表の右側にあるハロゲンは電子を受け取りやすいです。受け取ると希ガスと同じ電子配置となるため、閉殻またはオクテットとなり安定的になるので大きなエネルギーを発生します。
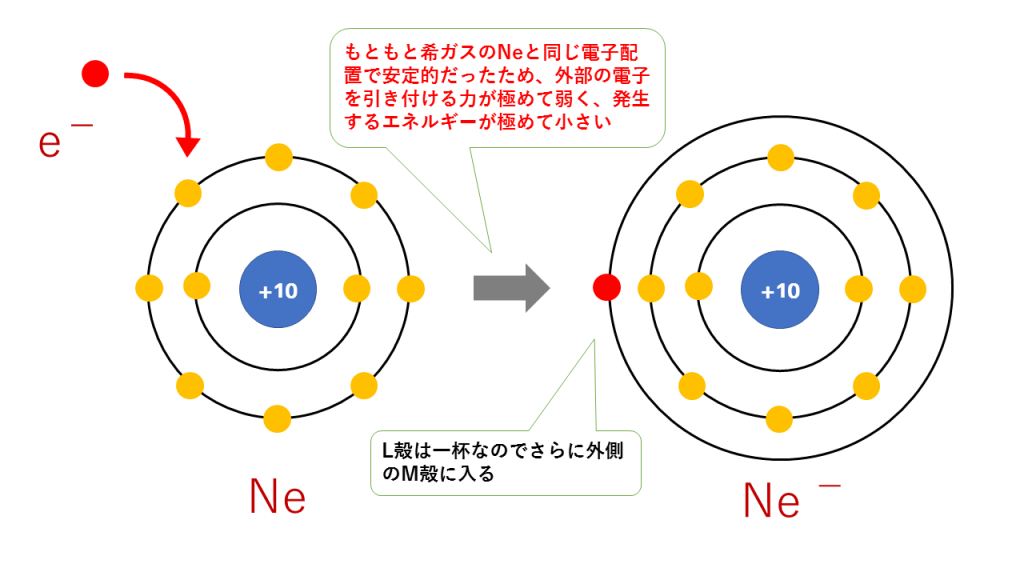
これに対し、希ガスはすで閉殻またはオクテットで非常に安定的なので、外部の電子を引き付ける力はほとんどありません。そのため、希ガスの電子親和力はほぼ0やむしろマイナスです。希ガスはすでに最外殻がいっぱいだから電子を加える場所がないというイメージです。
電子親和力のグラフ
結論としては、同一周期において
ハロゲンは電子親和力が最大
希ガスは電子親和力が極めて小さい
ということです。
イオン化エネルギーは希ガスが最大だった点と異なりますね。
参考までに以下が電子親和力の大きさに関するグラフです。
イオン化エネルギー・電子親和力・電気陰性度の共通点と違いを参照してください。
イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径について
根本的な考え方が同じである「イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径」についての他記事は以下を参照ください。
さいごに
イオン化エネルギーとともに自分で説明できるレベルになっておくべきなのが、本記事の電子親和力です。
どちらも友達同士で説明しあってみるなどして、理解を深めることをおすすめします。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。