周期表における原子半径(原子の大きさ)の大小関係も、イオン化エネルギーや電子親和力などと同様に、「電子の引き付け度合い」というキーワードをもとにすることで同じような理屈で考えることができます。本記事では原子半径の大小の理由について具体的かつ丁寧に解説していきます。
僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
原子半径とは
原子半径とは、 原子を球形とみなしたときの半径のことです。
高校レベルでは、中心にある原子核から最外殻電子までのキョリと考えて良いです。
※実際の半径の測定数値に関しては様々な測定方法があるため、ざっくりとした理解で十分です。
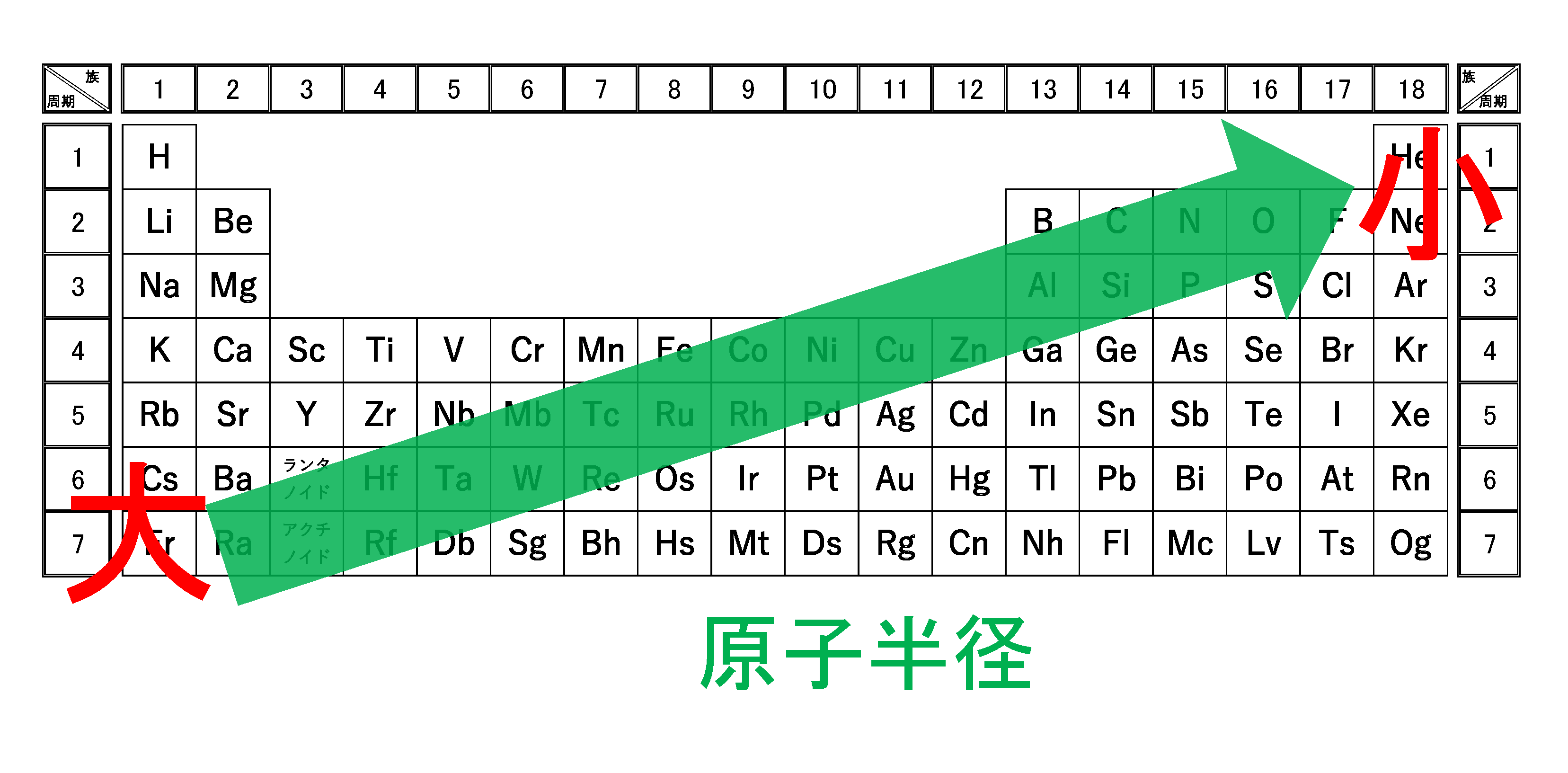
周期表の同一周期(横)における原子半径の大小関係
例えば、周期表の第2周期(Li~Ne)をもとに説明していきます。
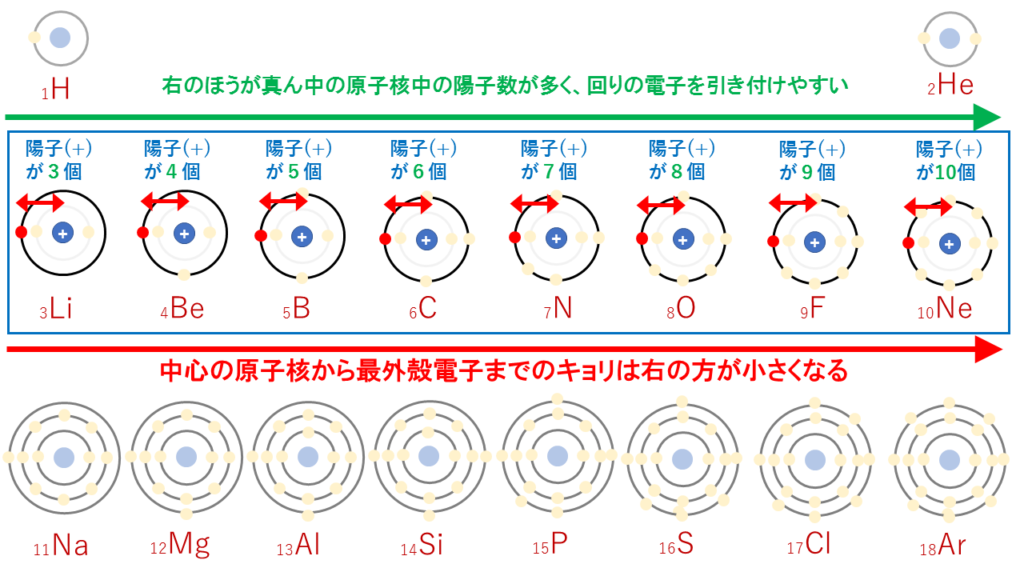
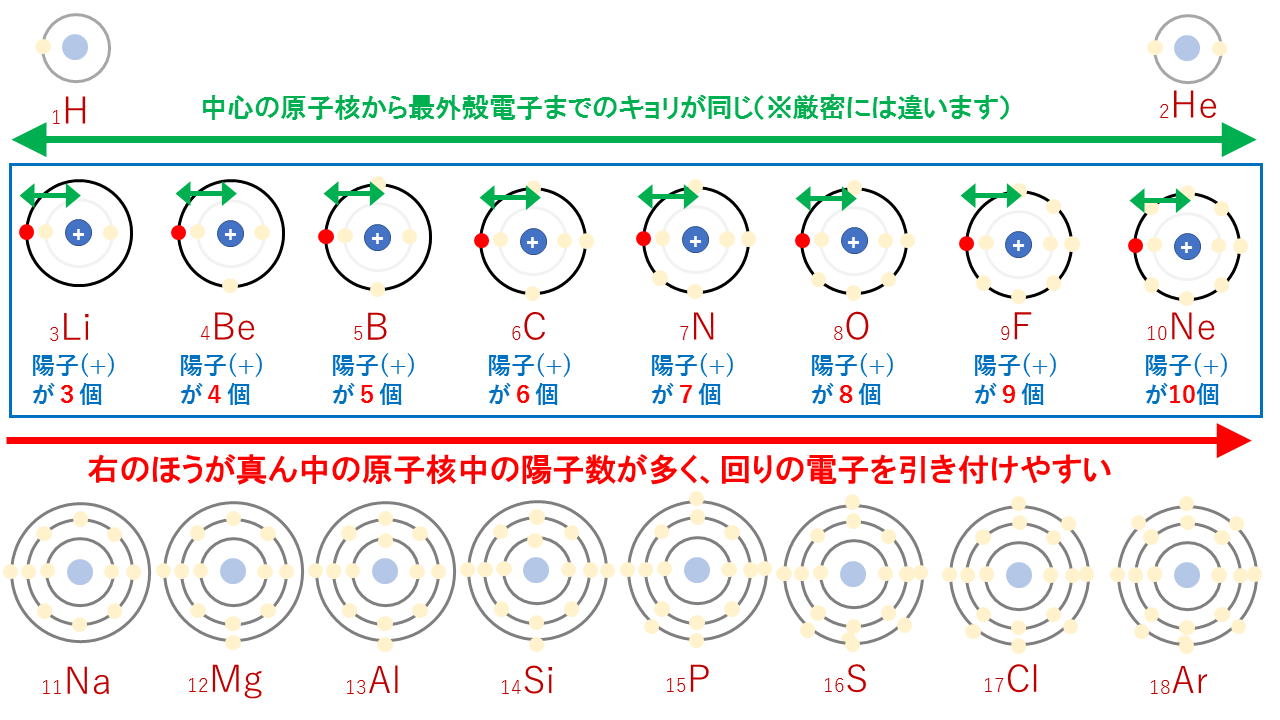
第2周期の最外殻はすべてL殻で同じです。
しかし、真ん中の原子核内にある陽子(+)の個数が違います。
真ん中の原子核内にある陽子(+)が多いほど、回りの電子を引き付けやすいはずです。つまり、周期表の右側の方が原子番号が大きく、陽子数が多いため、電子を引き付ける強さが強くなります。そのため、右側の方が原子半径が小さくなります。
周期表の同一族(縦)における原子半径の大小関係
それでは次に、周期表の同一族(縦)について考察します。
例えば、周期表の第1族(H,Li,Na,…)をもとに説明していきます。
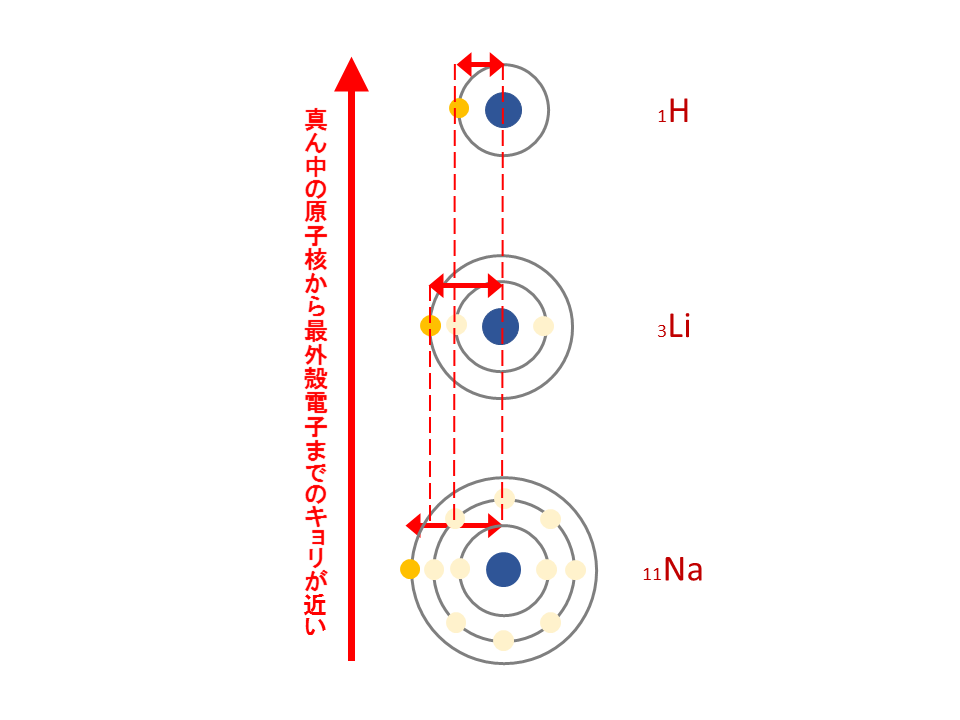
第1周期のHeの最外殻はK殻であり、真ん中にある原子核からの距離が最も近いです。
第2周期のNeの最外殻はL殻であり、真ん中にある原子核からの距離が少し遠ざかります。
第3周期のArの最外殻はM殻であり、真ん中にある原子核からの距離がさらに遠ざかります。
ここでよくある疑問です。『確かに周期表の下の方は距離が遠くなるが、その分原子番号が大きいので、陽子数が増え、引きつける力も増すのでは?』
その通りなんです。陽子数が増えることと、距離が遠くなることのどちらの影響が強いかの兼ね合いになります。
ここで物理の公式を紹介します。静電気力に関するクーロンの法則
$$F = k\frac{Qq}{r^2}$$
というものです。
2つの電荷がある際に及ぼし合う引力(または斥力)の大きさに関する公式です。
k は比例定数で、r は2つの電荷の距離、Q とq はそれぞれの電気量(陽子や電子の個数みたいなイメージ)です。
今、電子1個を取り去る話をしているので、電子1個と原子核(陽子複数個)との間の静電気力を比較します。
Q とq のうち、片方は電子1個で共通しているので、
静電気力は原子核の陽子数の1乗に比例し、最外殻電子までの距離の2乗に反比例します。
もちろん2乗の方が影響力が強いです。そのため、周期表の下の方は陽子数が増えるけれど、距離が遠くなることの方が影響力があるため、静電気力(引力)が弱まります。よって、原子半径は上の方が小さくなります。
原子半径は周期表の右上が最小
周期表において原子半径は右上が最小です。
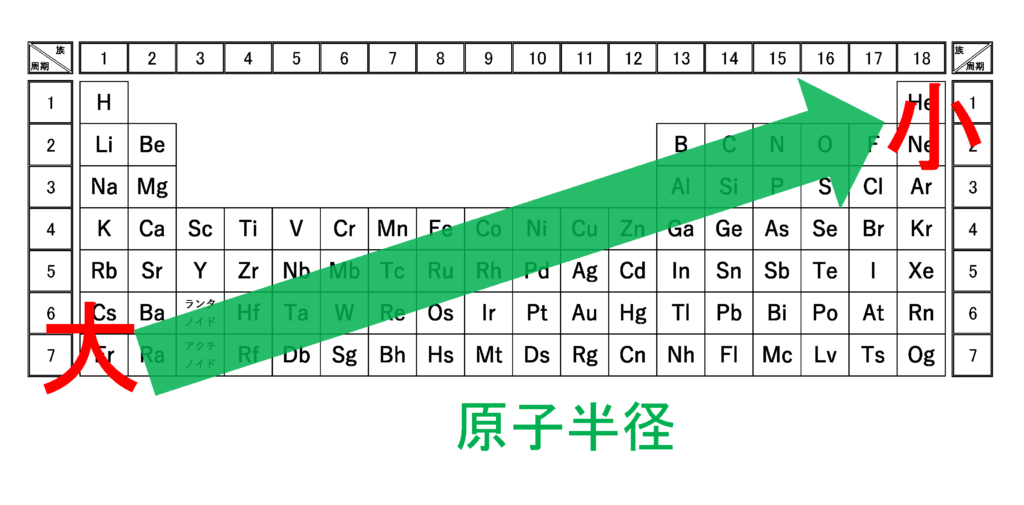
これだけ聞くとイオン化エネルギーや電子親和力、電気陰性度とは逆に見えますが、意味を理解すれば同じ考え方であることがわかります。
⇒ 周りの電子をグッと引き付けると小さくなるため、
周りの電子の引きつける力が強い
⇒ イオン化エネルギーや電子親和力、電気陰性度と同じ
イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径について
根本的な考え方が同じである「イオン化エネルギー・電子親和力・電気陰性度・原子半径・イオン半径」についての他記事は以下を参照ください。
さいごに
原子半径は、イオン化エネルギーに比べると出題頻度は落ちますが、上記で説明したとおり全く同じように考えることができる単元です。必ず自分で説明できるようになっておきましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。