おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
酸・塩基の価数
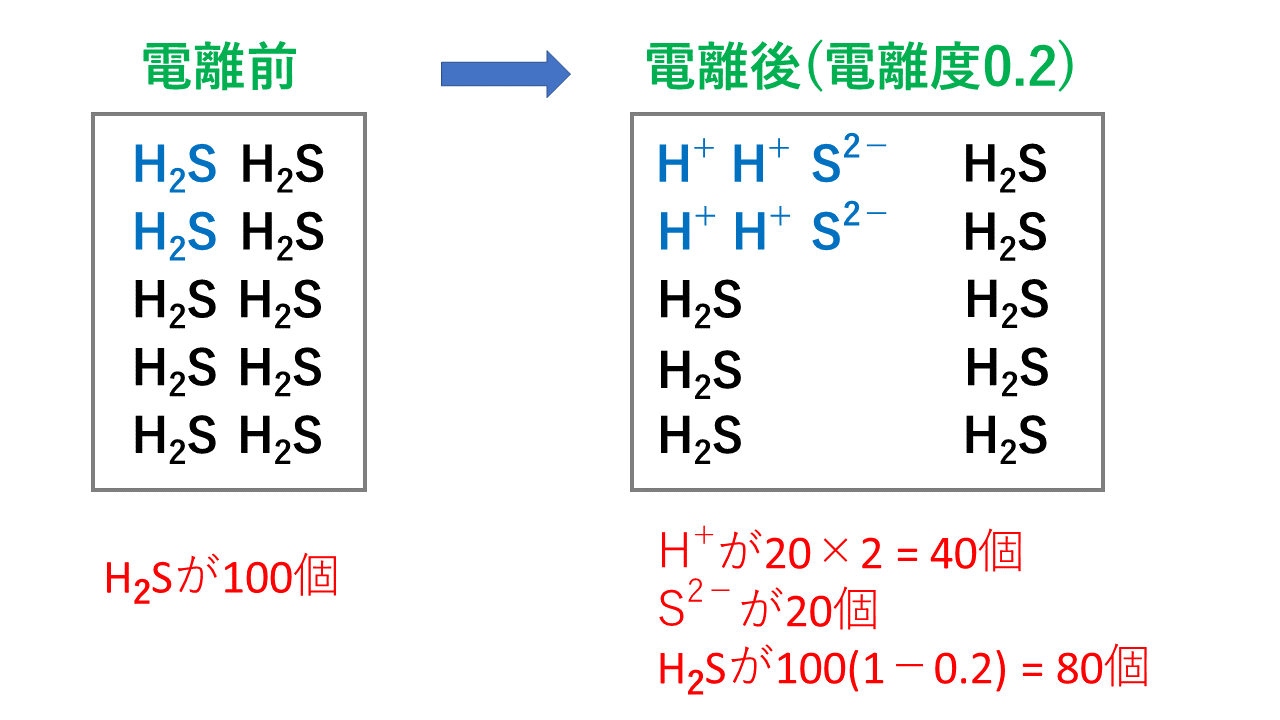
酸の価数とは、酸1分子が出しうる水素イオンH+の数のことであり、塩基の価数とは塩基1化学式が出しうる水酸化物イオンOH-の数または受けとることができる水素イオンH+の数のことです。 価数の覚え方としては、酸・塩基の化学式およびイオンの形を覚えることがベストです。化学式を見れば判断できる場合がほとんどであり、イオンの価数で確実に判断できます。HClは化学式中にHを1つもっているので1価の酸、Ca(OH)2は化学式中に2つのOHをもっているので2価の塩基となります。 ただし、このときに間違えやすいのがアンモニアと酢酸です。 アンモニアNH3はH+を1つだけ受け取りNH4+となるため価数は1です。3ではありません。 酢酸CH3COOHはH+を1つだけ放出しCH3COO-となるため価数は1です。3でも4でもありません。酸・塩基の価数の一覧
それでは高校化学(受験化学)で出題される酸・塩基の価数の一覧(強弱もついでに)を示します。 電離したときのイオンの価数と一致するので、イオンを覚えておけばすべて判断できます。酸の価数一覧表
| 酸一覧 | ||
|---|---|---|
| 強酸 | 価数 | 弱酸 |
| HCl(塩酸)→ H+ + Cl-HBr(臭化水素酸)→ H+ + Br- HI(ヨウ化水素酸)→ H+ + I- HNO3(硝酸)→ H+ + NO3- | 1価 | HF(フッ化水素酸)→ H+ + F-CH3COOH(酢酸)→ H+ + CH3COO- |
| H2SO4(硫酸)→ 2H+ + SO42- | 2価 | H2CO3(炭酸)→ 2H+ + CO32-H2S(硫化水素)→ 2H+ + S2- H2C2O4(シュウ酸)→ 2H+ + C2O42- または(COOH)2(シュウ酸)→ 2H+ + (COO)22- |
| 3価 | H3PO4(リン酸)→ 3H+ + PO43- | |
塩基の価数一覧表
| 塩基一覧 | ||
|---|---|---|
| 強塩基 | 価数 | 弱塩基 |
| NaOH(水酸化ナトリウム)→ Na+ + OH- | 1価 | NH3(アンモニア)→ NH4+ + OH- |
| Ca(OH)2(水酸化カルシウム)→ Ca2+ + 2OH- | 2価 | Cu(OH)2(水酸化銅)→ Cu2+ + 2OH-Mg(OH)2(水酸化マグネシウム)→ Mg2+ + 2OH- Zn(OH)2(水酸化亜鉛)→ Zn2+ + 2OH- |
| 3価 | Al(OH)3(水酸化アルミニウム)→ Al3+ + 3OH-Fe(OH)3(水酸化鉄)→ Fe3+ + 3OH- | |