【アニメーション付き解説】配位結合とは、共有結合とはできる仕組みが異なるだけで、結合ができたあとは区別がつかないものです。結論から言うと、共有結合は1:1、配位結合は2:0という違いがあります。本記事では、この意味、構造式中の矢印の意味、錯イオンの形成の仕組みなどをアンモニアなどの具体例をもとにアニメーション付きで解説します。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
配位結合とは
一方の原子からの非共有電子対が,他方の原子からはそれを受け入れる空軌道が提供されてできる共有結合を配位結合といいます。
配位結合は結合のできるしくみが異なるだけで,できた結合はふつうの共有結合とは全く変わりません。
配位結合と共有結合の違い
共有結合は1:1で電子を共有する仕組みの結合で、配位結合は2:0で電子を共有する仕組みの結合です。結合した後は見分けがつきません。
※共有結合についての詳細は、 共有結合とは?二酸化炭素などの例を図でわかりやすく解説 を参照してください。
配位結合の具体例と構造式、矢印の意味
アンモニウムイオン
アンモニア中の窒素原子の非共有電子対を、電子をもたない水素イオンに一方的に与えることで結合が形成されます。
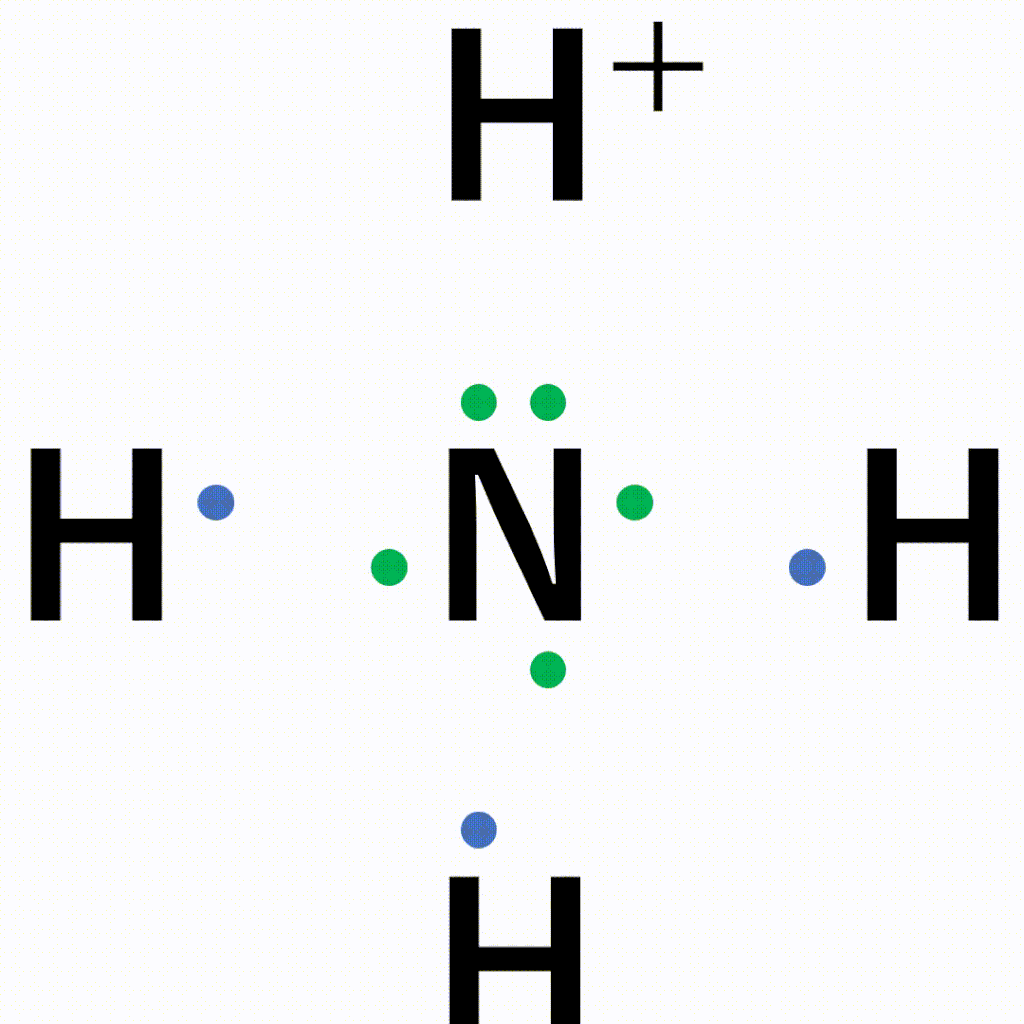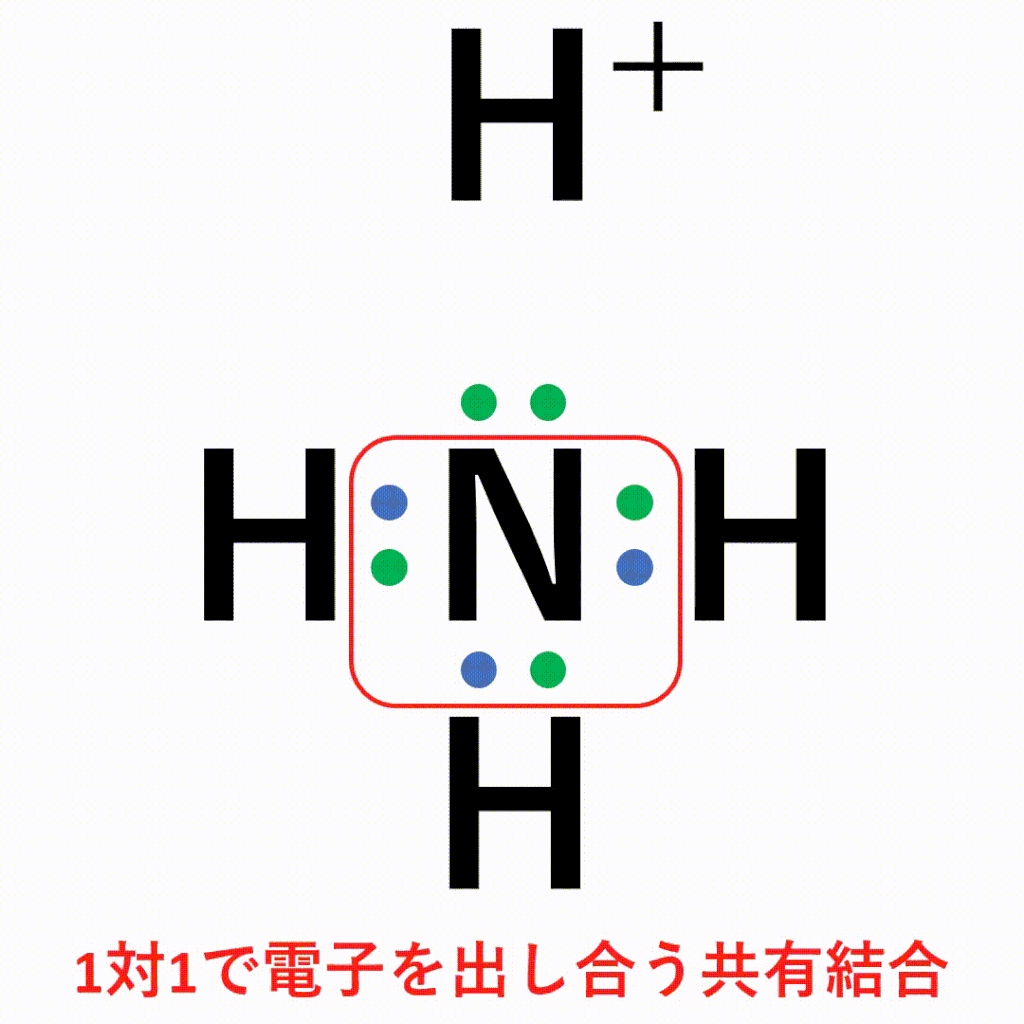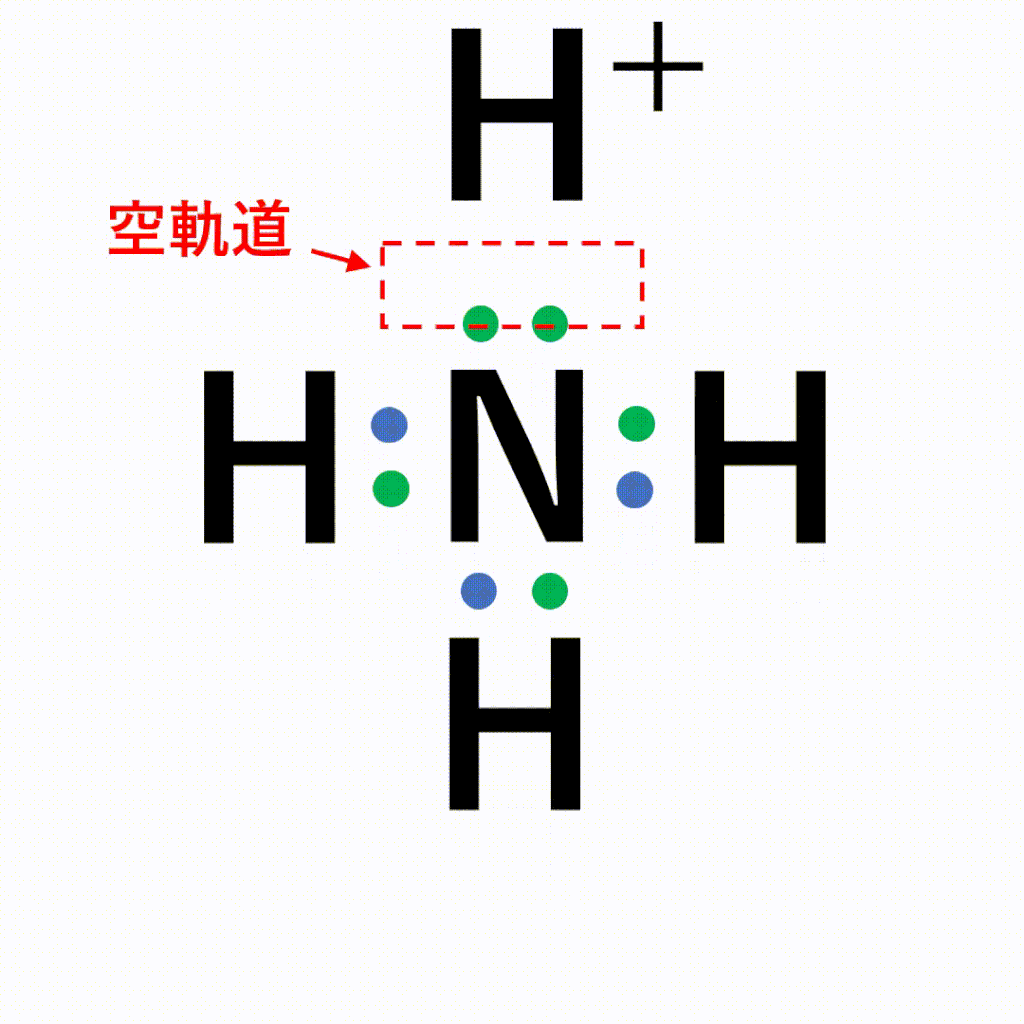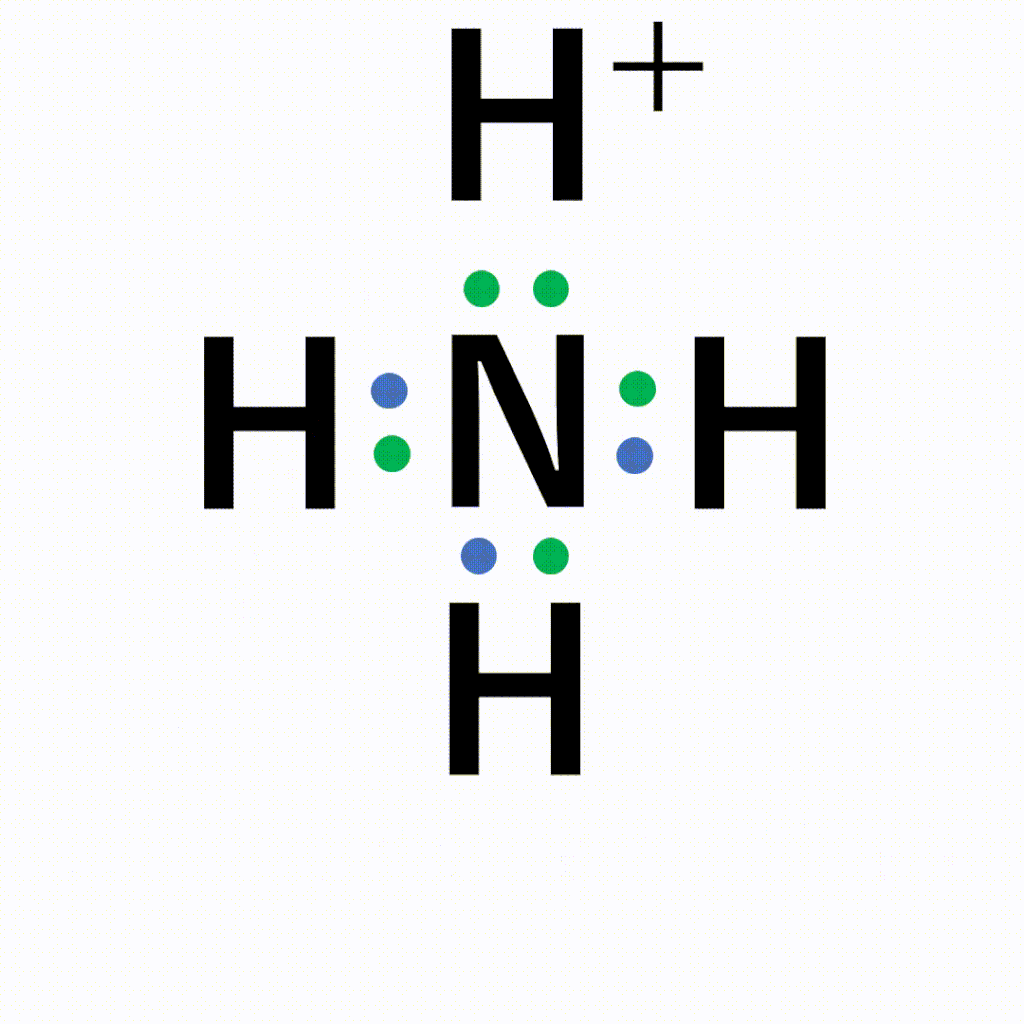
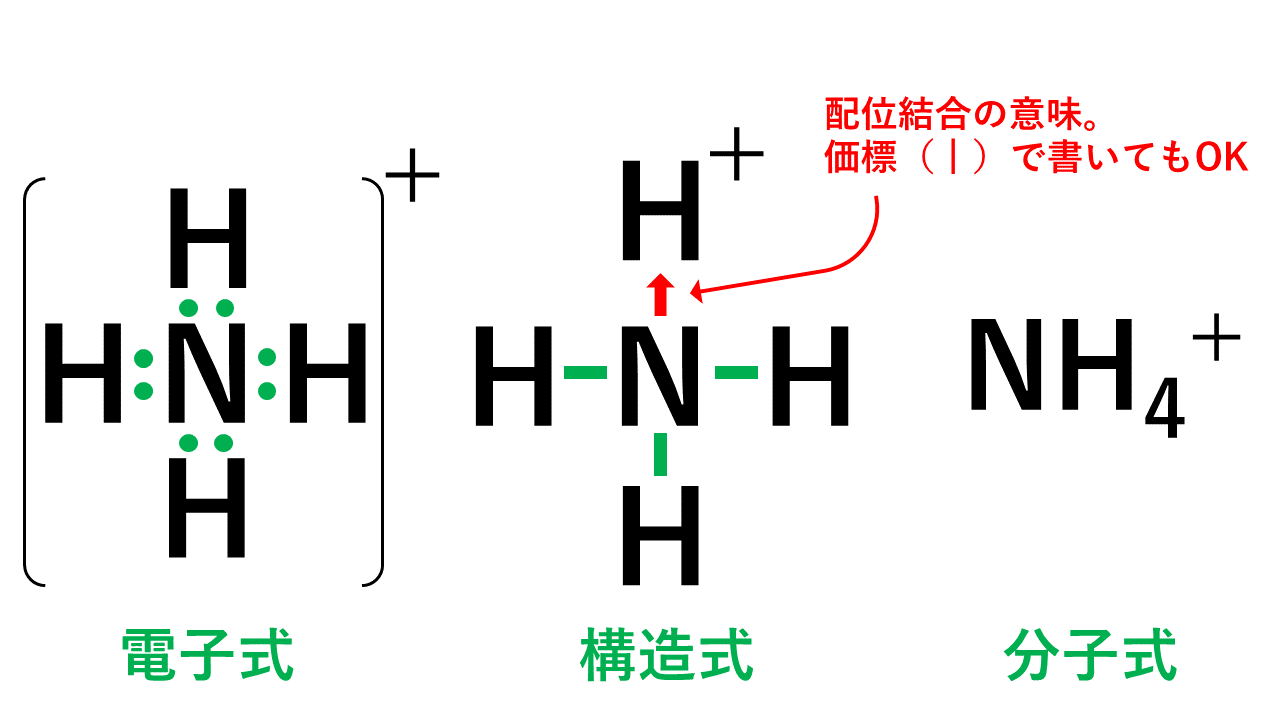
アンモニウムイオンは、±0であるアンモニア分子と+1の水素イオンが配位結合しているため、全体で+1になります。結合後は共有結合でくっついた水素なのか配位結合でくっついた水素なのかの見分けはつかないため、以下のように電子式はトータルで「+」と書きます。
構造式では、配位結合の部分を「矢印」で表すこともあります。この場合、矢印の向きは電子を与える方向に書きます。しかし、矢印で必ず書かなければならないというわけではなく、価標(棒線)で書いても構いません。ただし、矢印で書いた方が配位結合が存在することが示せるというメリットがあるため、こういった記述が存在します。
オキソニウムイオン
水の中の酸素原子の非共有電子対を、電子をもたない水素イオンに一方的に与えることで結合が形成されます。
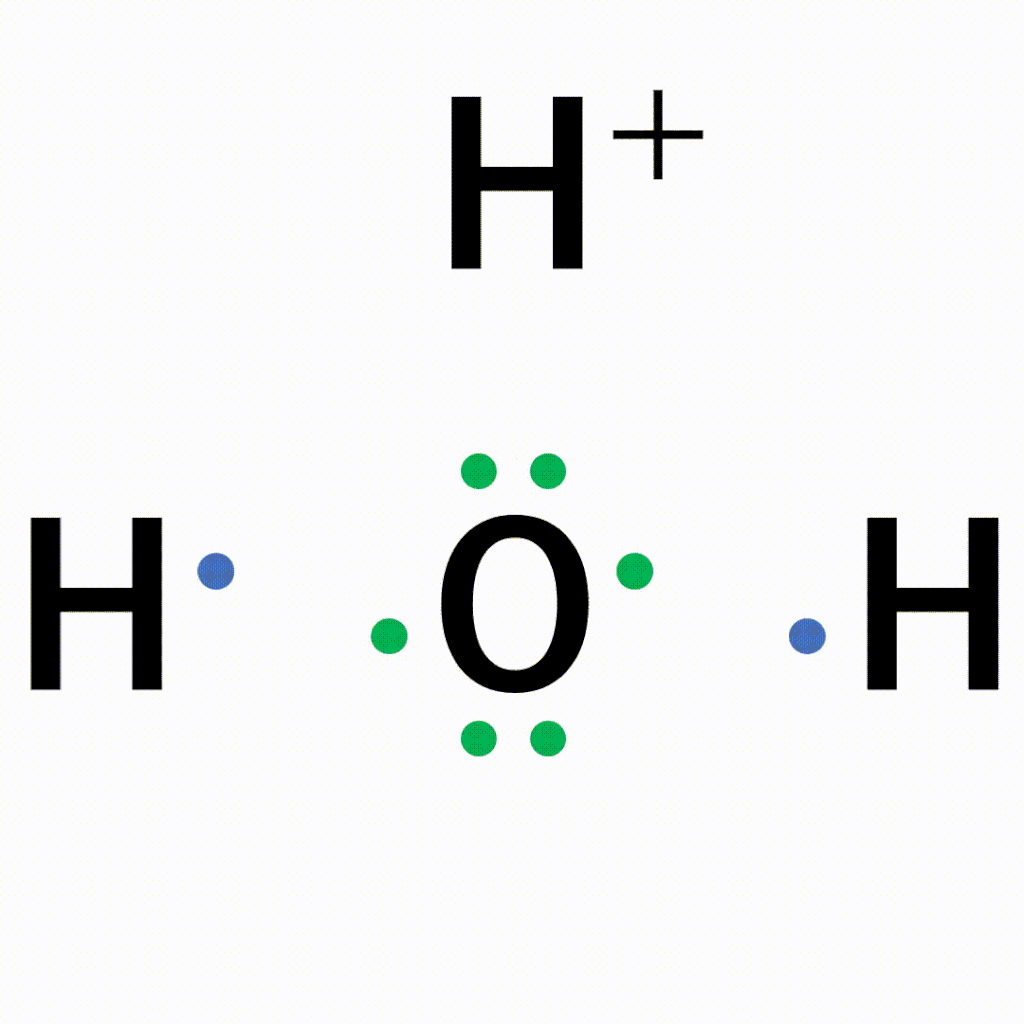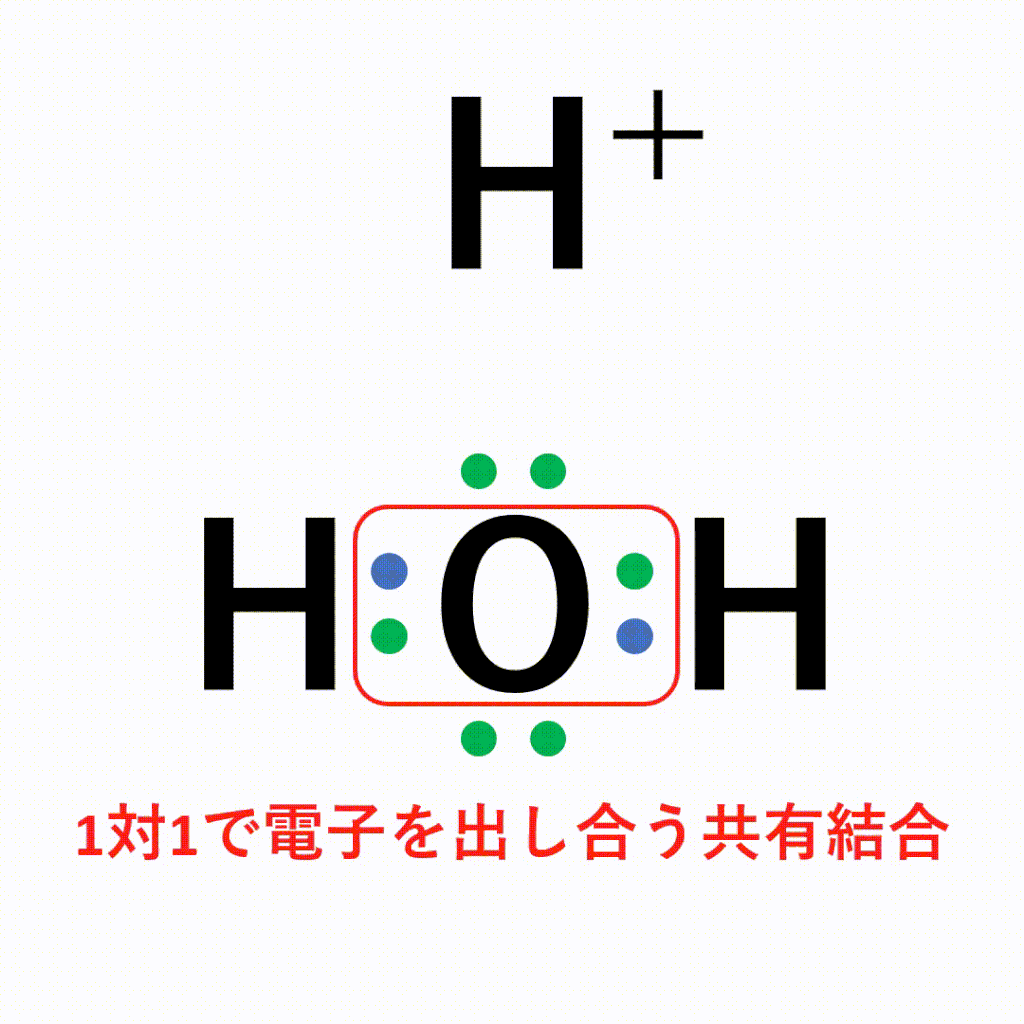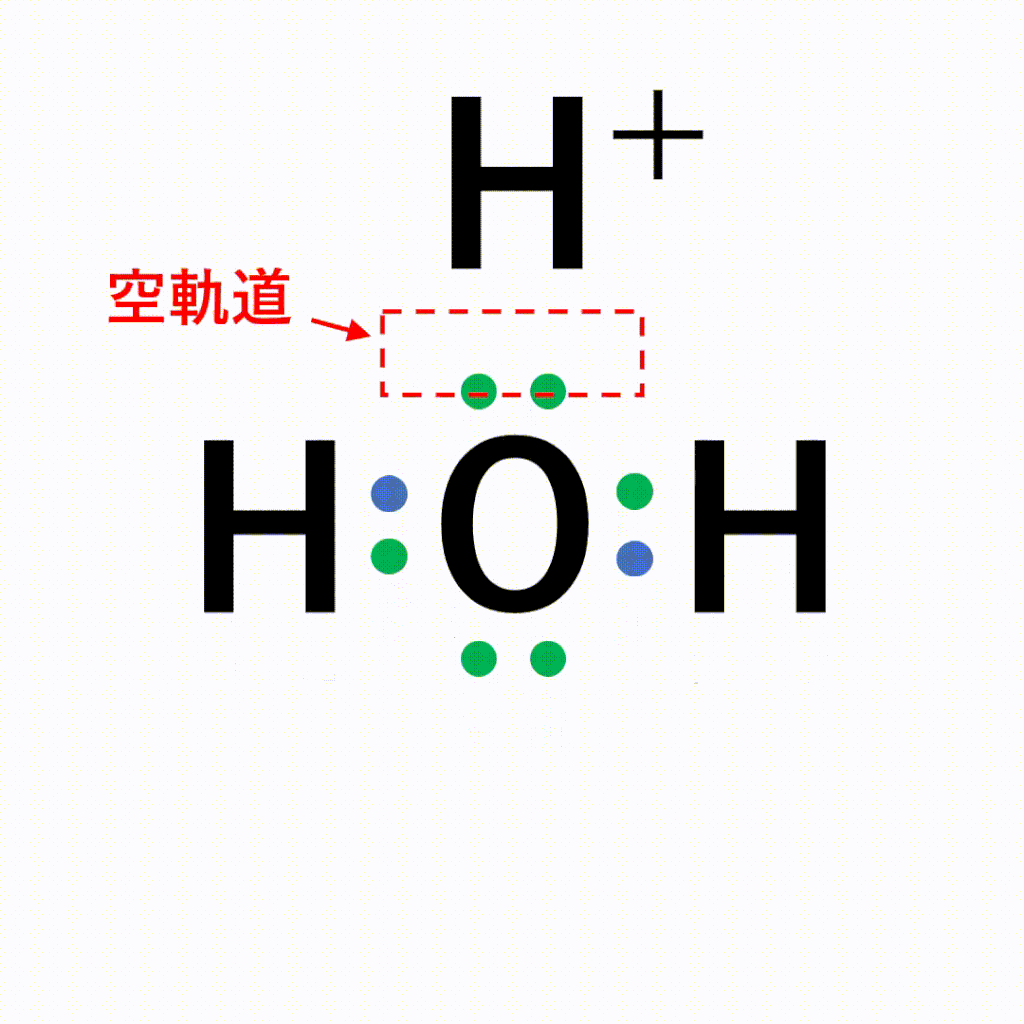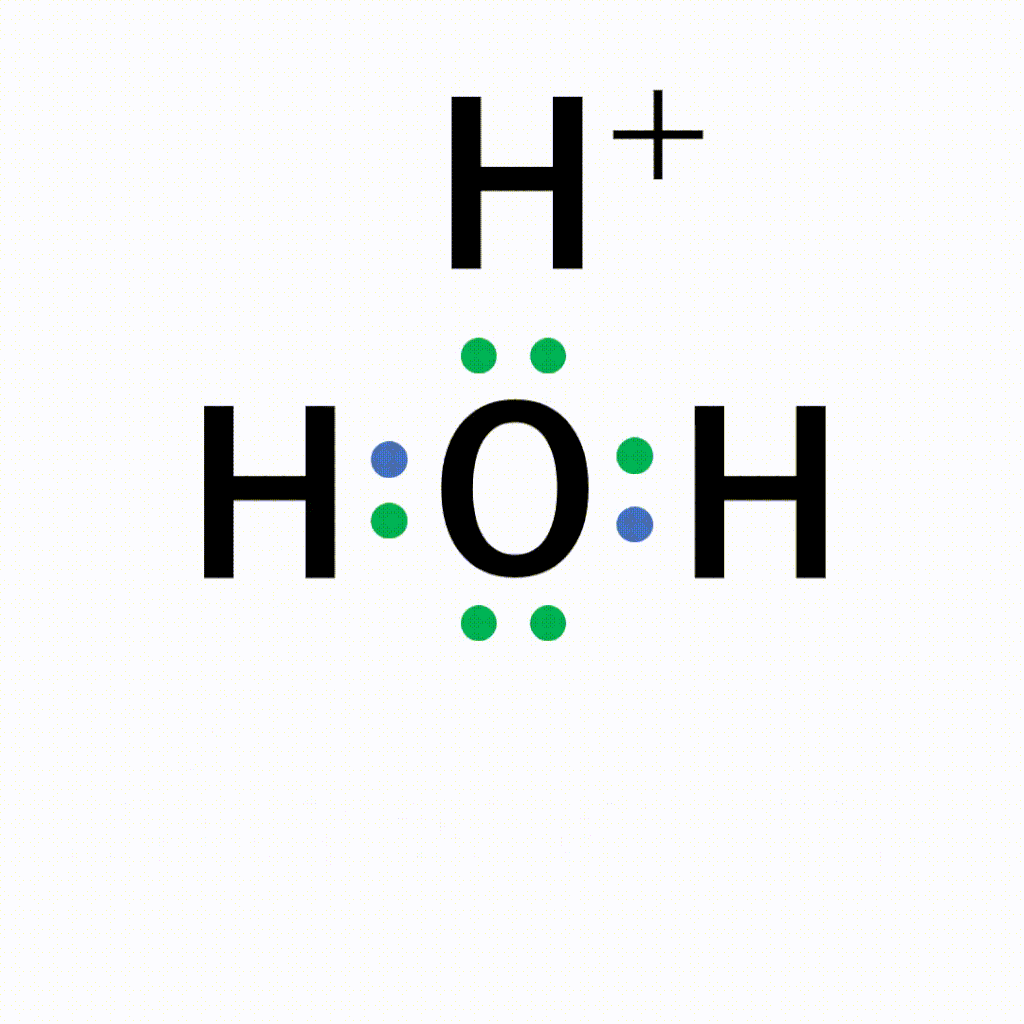
オキソニウムイオンは、±0である水分子と+1の水素イオンが配位結合しているため、全体で+1になります。結合後は共有結合でくっついた水素なのか配位結合でくっついた水素なのかの見分けはつかないため、以下のように電子式はトータルで「+」と書きます。
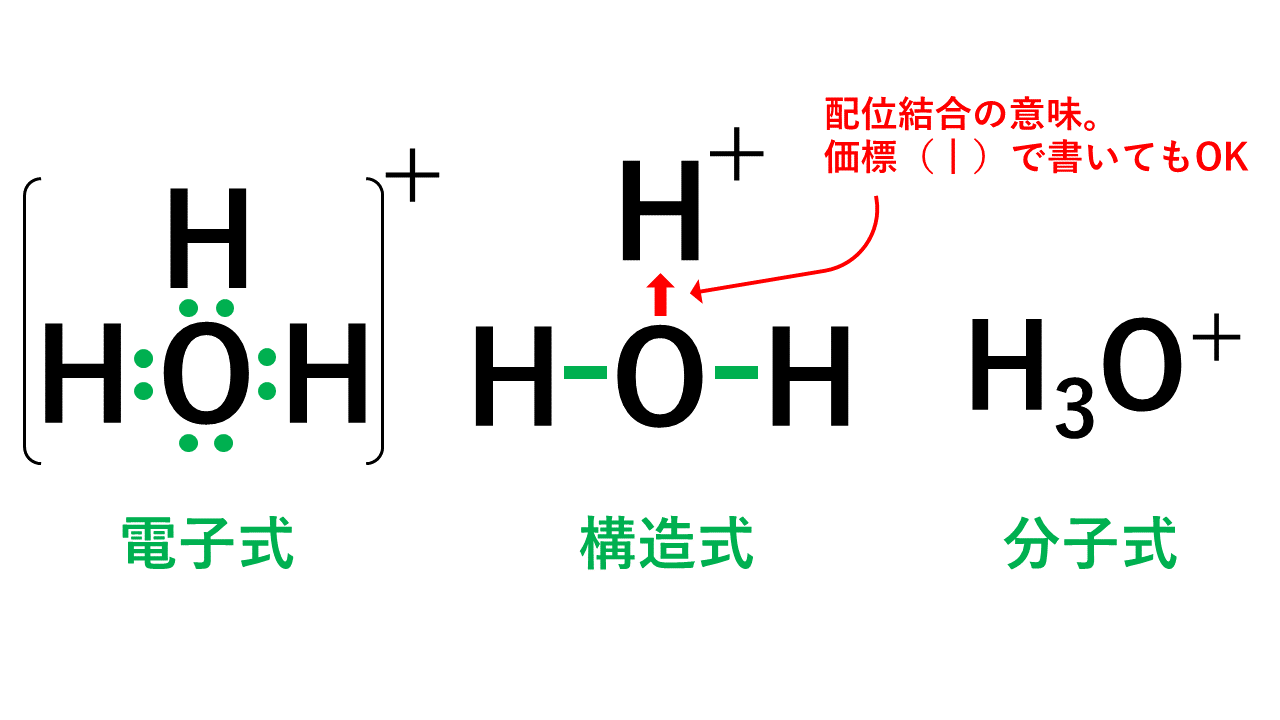
本来これまで書いてきた水素イオンは溶液中では存在しません。一般的にはこのオキソニウムイオンとして存在しているとされています。なぜなら、水素イオンは陽子1個と電子1個の状態から電子1個を放出しているため、陽子1個の状態のため不安定だからです。そのため配位結合で安定化しています。
錯イオンの形成の仕組み
アンモニアや水酸化物イオン、シアン化物イオンなどのように非共有電子対をもつ分子やイオンが金属イオンの空軌道に電子を与えるという配位結合によりできた多原子イオンを錯イオンといいます。
それでは、錯イオンの形成の仕組みを解説します。
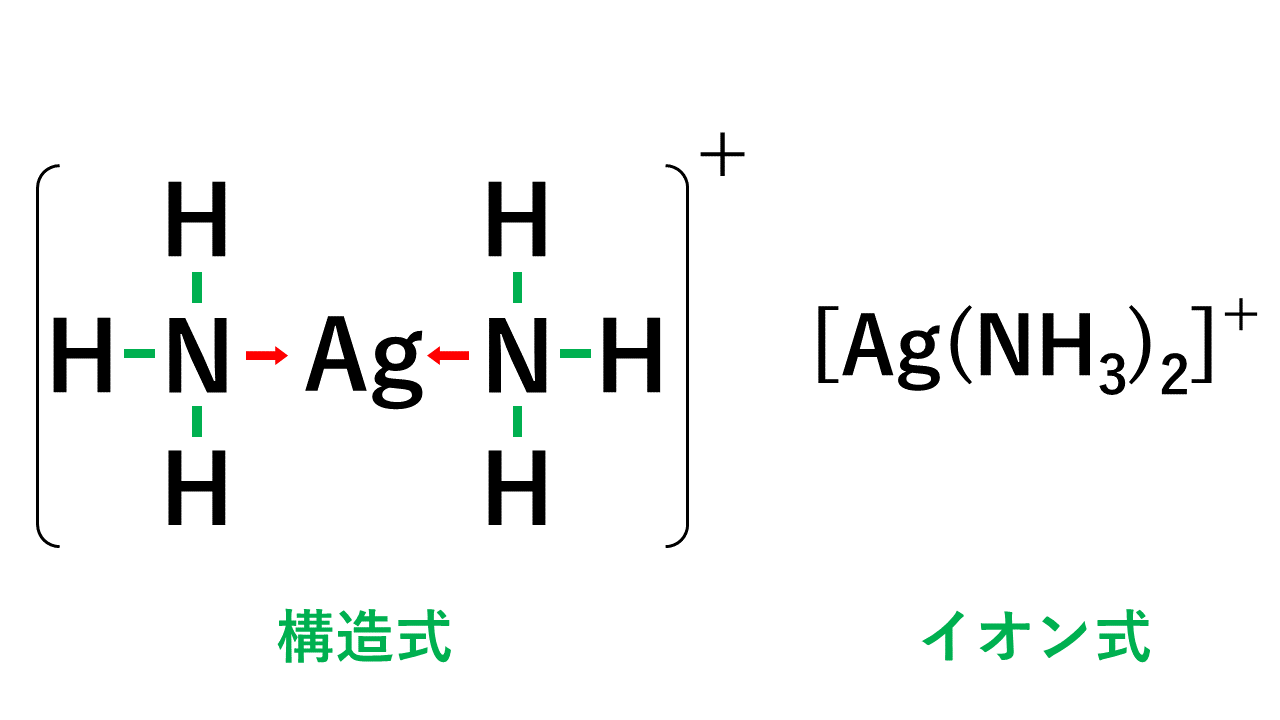
ジアンミン銀イオンの形成の仕組み

銀イオンには空軌道が2つあります。そこにアンモニア分子2個が、それぞれの非共有電子対を分け与え配位結合します。これによりできるのがジアンミン銀イオンです。
さいごに
配位結合はできたあとは共有結合とまったく同じですが、できる仕組みが異なるだけです。2対0か1対1かという違いを押さえておくとよいでしょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。