【図解】高校化学基礎より、原子の構造、分子との関係性、原子と元素の違い、陽子・中性子・電子・質量数・原子番号の関係性と違い、原子核とは何かなど、具体的に図を示しながら丁寧に解説します。
僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
元素
物質を構成する基本的な成分のことです。現在,約100種類の元素が見つかっています。
単体
1種類の元素からなる物質。(例)O2,H2,N2,Feなど
化合物
2種類以上の元素からなる物質。(例)H2O,NH3 ,NaClなど
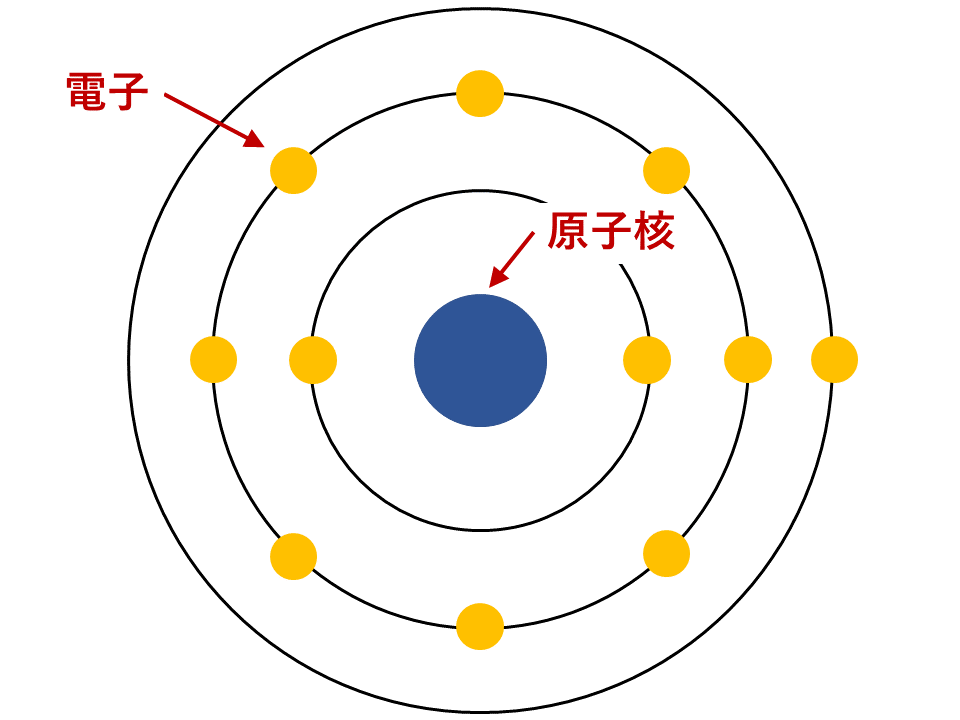
原子の構造
原子の大きさ
直径10-10m程度の粒子です。
ちなみに10-10というのは
$$\frac{1}{10^{10}}$$
という意味です。
すべての物質は原子から構成されています。
私たちの体も机もスマホも空気も水も建物もすべてです。
原子は原子核と電子からできており、原子核の周りを電子がぐるぐると回っています。
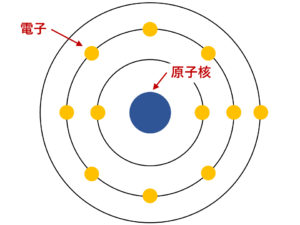
しかも、原子核は直径10-15~10-14m程度、つまり
$$\frac{1}{10^{15}}$$
程度なので、原子核と原子では、105倍くらいの違いがあります。
105倍というと、10万倍の差です。
原子核が1円玉の大きさと仮定すると、原子は東京ドームくらいの大きさになります。
それくらい大きさに違いがあります。
原子の質量と電荷
下の表のように原子核は陽子と中性子からできています。
陽子とはプラスの性質をもった粒子です。
中性子は電荷を帯びていません(プラスマイナスゼロ)。
電子はマイナスの性質をもった粒子です。
このため、陽子の影響でプラスの性質をもった原子核とマイナスの性質をもった電子がお互いに引き合うことで回転しています。
地球の周りを月がグルグル回っているのもお互いに引き合っている(=万有引力)からですね。
これと同じ仕組みです。
| 粒子 | 電荷 | 質量比 | |
| 原子核 | 陽子 | +1 | 1 |
| 中性子 | 0 | 1 | |
| 電子 | -1 | 約1/1840 | |
次に質量比を見ると、陽子と中性子の質量比に対して電子の質量比は約1/1840とかなり小さいです。そのため、原子トータルの質量を考えるときには電子の質量は無視できますね。
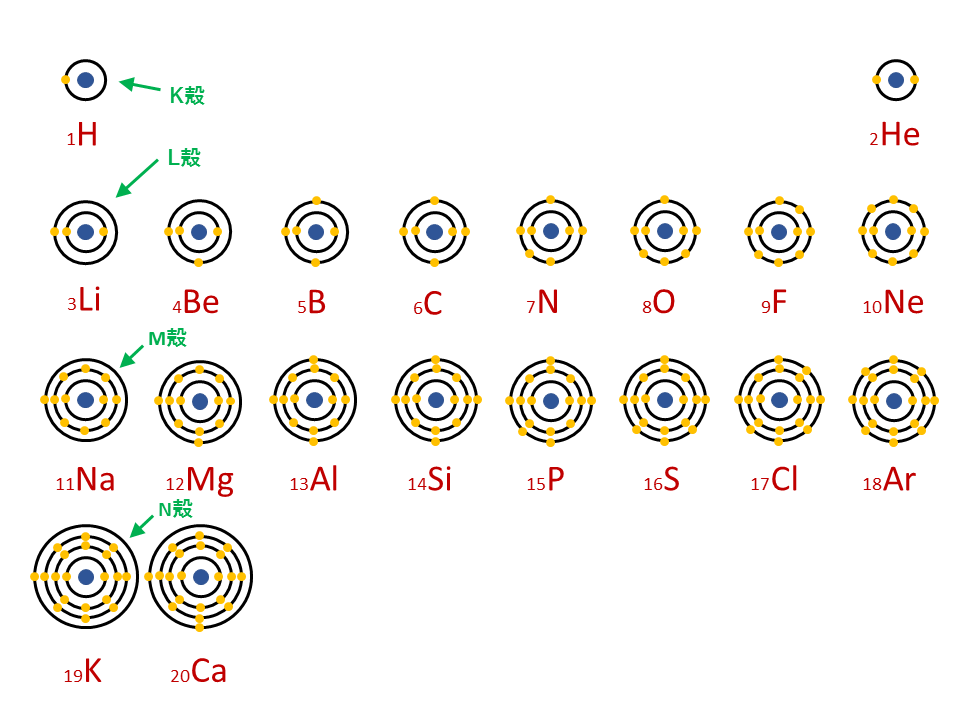
原子番号
原子核中の陽子の数はそれぞれの元素に固有のもので,陽子の数が変われば元素が変わります。
原子番号=陽子の数=(電子の数)
質量数
真ん中の原子核中の陽子の数+中性子の数
陽子と中性子に比べると、周りをグルグル回っている電子の質量は軽すぎるため無視できます。
元素記号
元素記号は以下の図のようなルールで記述されます。

この例の元素Naはナトリウムという元素です。
陽子の数は電子の数と同じなので、電子の数も11コ
陽子の数+中性子の数=質量数であり、質量数が23なので、中性子の数は23-11=12コ
となります。
書き方のルールを覚えておきましょう。
なかなか覚えられない人は、そもそも勉強法が間違えているかもしれません。
そのような方は以下を参考にしてください。
【間違いだらけの勉強法】成果の出る化学の勉強法とは?|現役プロ講師が1000名以上の個別指導で蓄積したノウハウを公開
原子・分子・元素の違い
最後に、原子・分子・元素の違いについて説明します。
例えば、水H2Oの場合、
水素原子2個と酸素原子1個の3個の原子からできた分子です。
元素としては水素と酸素の2種類と考えます。
つまり、
原子は物質を構成する粒子のことで、
元素は原子の種類のことです。
分子は非金属の原子がいくつか結合し安定な形になった物質のことです。
ちなみに、スタディサプリの坂田先生が解説されている動画がyoutubeにありましたので、以下参考に。
わかりやすいですよね。
このほかにもこんな感じで分かりやすく解説されています。
スタディサプリが気になる方は、僕なりの分析をしているので以下参考にしてください。
また、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。