中和反応または中和とは、酸と塩基が反応したとき,酸から塩基へ水素イオンが移り,互いの性質が打ち消されることです。塩酸、酢酸、シュウ酸、炭酸などの酸と、アンモニア、水酸化ナトリウムなどの塩基(アルカリ)を用いた中和反応の化学反応式の書き方と具体例と基本的な計算方法を解説したうえで、実際の練習問題を通して、自分で解く力をつけましょう。
ちなみに僕は10年以上にわたりプロとして個別指導で物理化学を教えてきました。
おかげさまで、個別指導で教えてきた生徒は1000名以上、東大京大国公立医学部合格実績は100名以上でして、目の前の生徒だけでなく、高校化学で困っている方の役に立てればと思い、これまでの経験をもとに化学の講義をまとめています。参考になれば幸いです。
中和反応とは
中和反応または中和とは、酸と塩基が反応し、互いの性質が打ち消されることです。
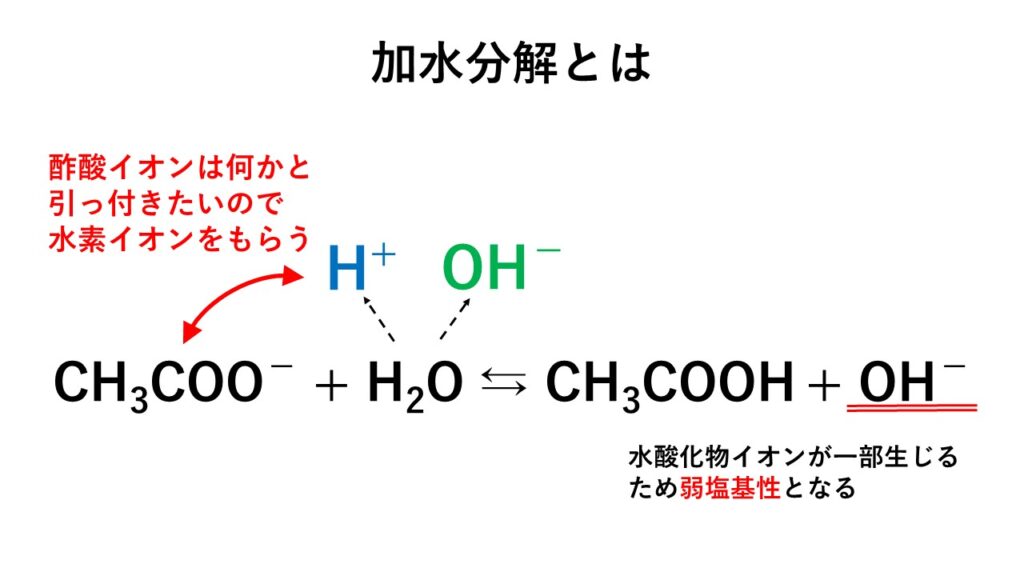
そして、中和の本質とは、酸の水素イオンH+と塩基の水酸化物イオンOH–から水H2Oが生じることです。
その際、副生成物として、塩が生じます。
以下、塩酸と水酸化ナトリウムを例に解説します。
水溶液において、塩酸は水素イオンと塩化物イオンに電離し、水酸化ナトリウムはナトリウムイオンと水酸化物イオンに電離します。
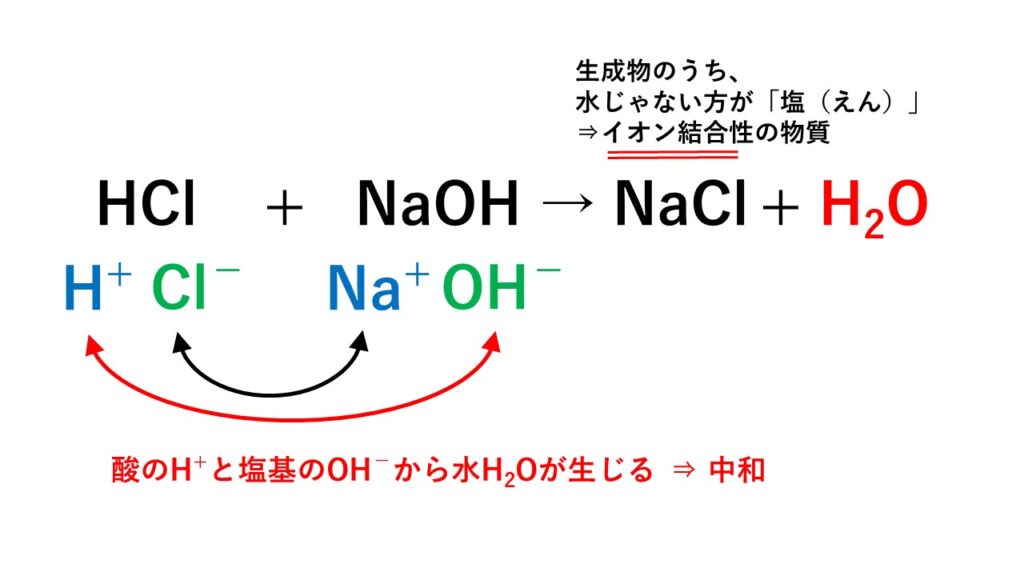
塩酸と水酸化ナトリウム水溶液を混合すると、電離した水素イオンと水酸化物イオンが反応して水となります。
この影響により、水素イオンを生じるという酸の性質、水酸化物イオンを生じるという塩基の性質が打ち消されます。これが中和の本質的な意味合いです。
また、その際、酸の陰イオン(塩酸だとCl-)と塩基の陽イオン(水酸化ナトリウムだとNa+)をまとめて表記した化合物のことを「塩(えん)」といいます。
中和の化学反応式の書き方
硫酸と水酸化カリウムの中和反応を題材に反応式の書き方を解説します。
H2SO4 + KOH
H2SO4 + 2KOH
この場合、H2SO4 には2つのH+ 、KOHは1つのOH- なので、KOHの係数を2にします。
H2SO4 + 2KOH → 2H2O
②で2つずつ水素イオンと水酸化物イオンを使用したので、右辺にも水H2Oが2つ必要になります。
H2SO4 + 2KOH → 2H2O + K2SO4
③の段階までで、左辺にある硫酸のSO42-を1つ、水酸化カリウムのK+を2つ右辺では使っていませんので、それらを組み合わせた塩K2SO4を書きます。
代表的な中和反応の化学反応式一覧
よく出題されている中和反応の反応式を書いておきます。酸や塩基それぞれの電離状態を覚えておけば、上の書き方と同じ方法ですべて書くことができます。
酸・塩基の価数や電離状態を忘れた人は【完全版】酸・塩基の価数の意味・覚え方・一覧と多段階電離を参考にしてください。
塩酸と水酸化ナトリウムの中和反応
HCl + NaOH → H2O + NaCl
塩酸とアンモニアの中和反応
HCl + NH3 → NH4Cl
アンモニアの場合は見かけ上H2Oが生じないのが特徴です。なぜなら、アンモニアは、
NH3+H2O → NH4++ OH‐となるため、水溶液中ではNH4+OH‐として存在します。
塩酸と反応すると、
HCl + NH4+OH‐ → H2O + NH4Cl
となり、両辺からH2Oを除いて書くと、
HCl + NH3 → NH4Clとなるためです。
酢酸と水酸化ナトリウムの中和反応
CH3COOH + NaOH → H2O + CH3COONa
硫酸と水酸化ナトリウムの中和反応
H2SO4 + 2NaOH → 2H2O + Na2SO4
硫酸とアンモニアの中和反応
H2SO4 + 2NH3 → (NH4)2SO4
シュウ酸と水酸化ナトリウムの中和反応
H2C2O4 + 2NaOH → 2H2O + Na2C2O4
または
(COOH)2 + 2NaOH → 2H2O + (COONa)2
炭酸と水酸化ナトリウムの中和反応
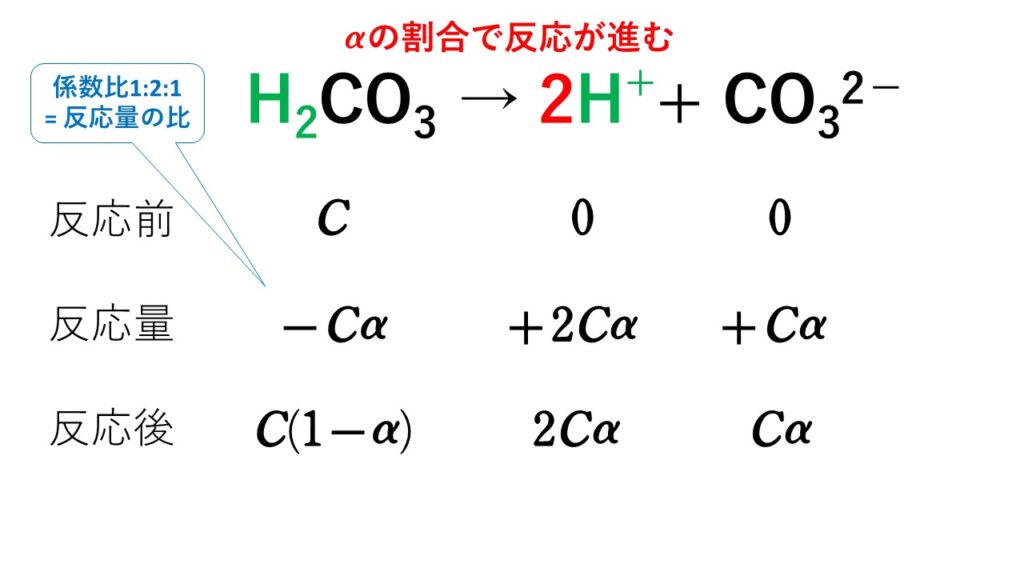
H2CO3 + 2NaOH → 2H2O + Na2CO3
中和の計算問題の解き方
まずは公式です。
酸の価数×モル = 塩基の価数×モル
そもそも、本記事の最初にお伝えしたとおり、
中和の本質とは、酸の水素イオンH+と塩基の水酸化物イオンOH–から水H2Oが生じることです。
だとすると、水素イオンのモルと水酸化物イオンのモルが一致するような量的関係になったとき、中和が完了したといえます。
ここで、酸がもつH+の物質量(mol)は、「酸の価数×酸の物質量(mol)」であり、
塩基がもつOH–の物質量(mol)は、「塩基の価数×塩基の物質量(mol)」で求めることができるため、
酸の価数×モル = 塩基の価数×モル
が成り立ちます。
中和の計算練習問題
H=1、O=16、Ca=40とする。
(1)濃度不明の水酸化ナトリウム水溶液15mLを中和するのに,0.30 mol/ Lの硫酸が10ml必要であった。
水酸化ナトリウムの濃度は何mol/ Lか。
(2)水酸化カルシウム1.85gを中和するのに,0.50mol/Lの塩酸が何mL必要か。
[su_spoiler title=”【解答解説】※タップで表示” style=”fancy”]どちらも酸の価数×モル = 塩基の価数×モルの形にします。
(1)
$$1 × x × \frac{15}{1000} = 2 × 0.30 × \frac{10}{1000}$$
より、
$$ x = 0.40 [mоl/L] $$
(2)Ca(OH)2=74
$$1 × 0.50 × \frac{V}{1000} = 2 × \frac{1.85}{74}$$
より、
$$ V = 100 [mL] $$
[/su_spoiler]モルの考え方を忘れた人は【5分でわかる】物質量・モル(mol)の考え方とアボガドロ定数の徹底解説を参考に、
モル濃度を忘れた人は【図解・練習問題付】モル濃度と密度、質量パーセント濃度の考え方を徹底解説を参考にしてください。
中和の量的関係に酸・塩基の強弱が無関係である理由
【完全版】酸・塩基の価数の意味・覚え方・一覧と多段階電離で解説したように、
強酸と弱酸では、水溶液中で電離している割合が異なります。
強酸では100%すべて電離しているのに対し、弱酸では一部しか電離しません。
具体的には、
強酸である塩酸なら、 HCl → H+ + Cl-とすべて電離している状態なので、そのまま塩基とすべて反応します。
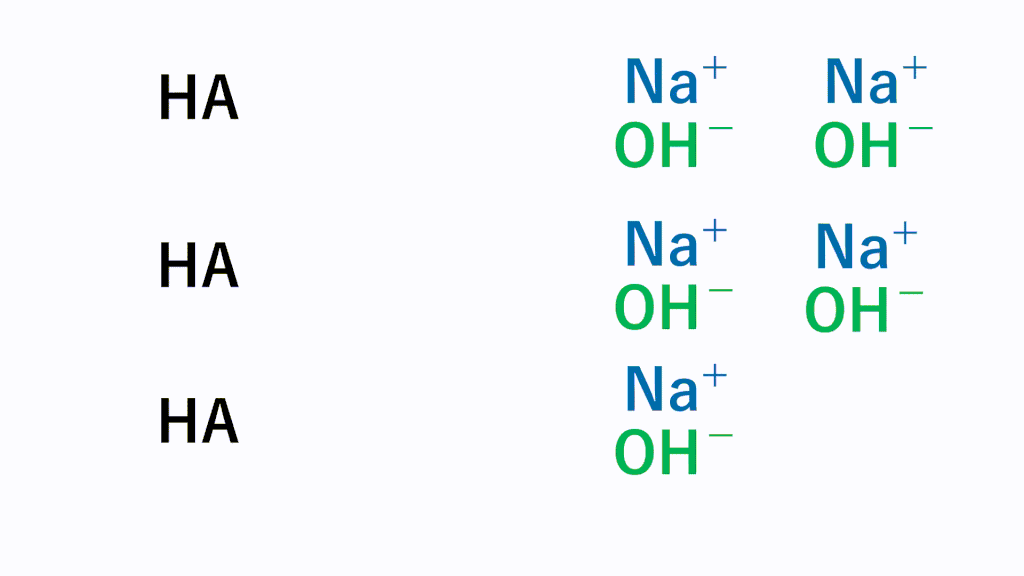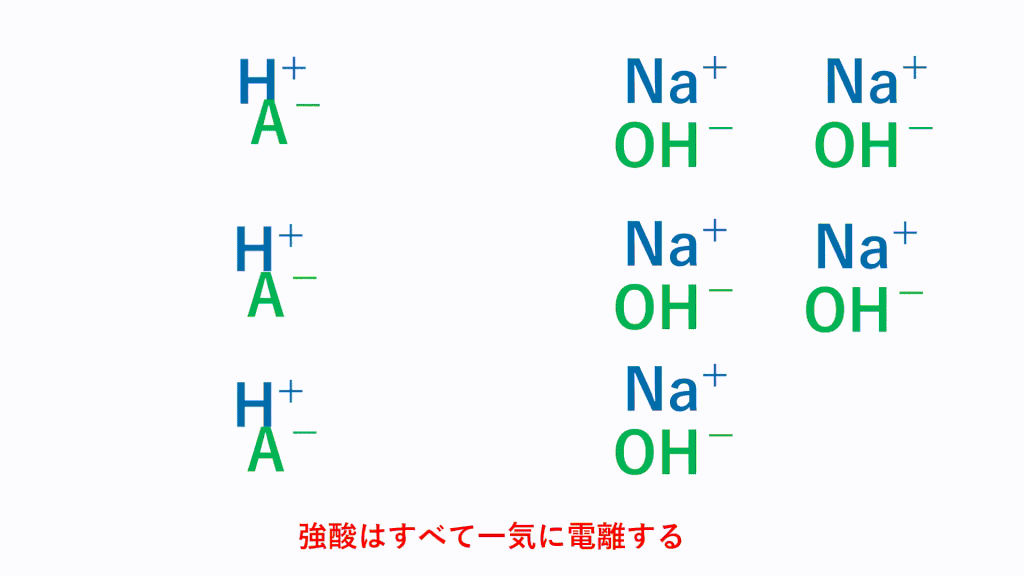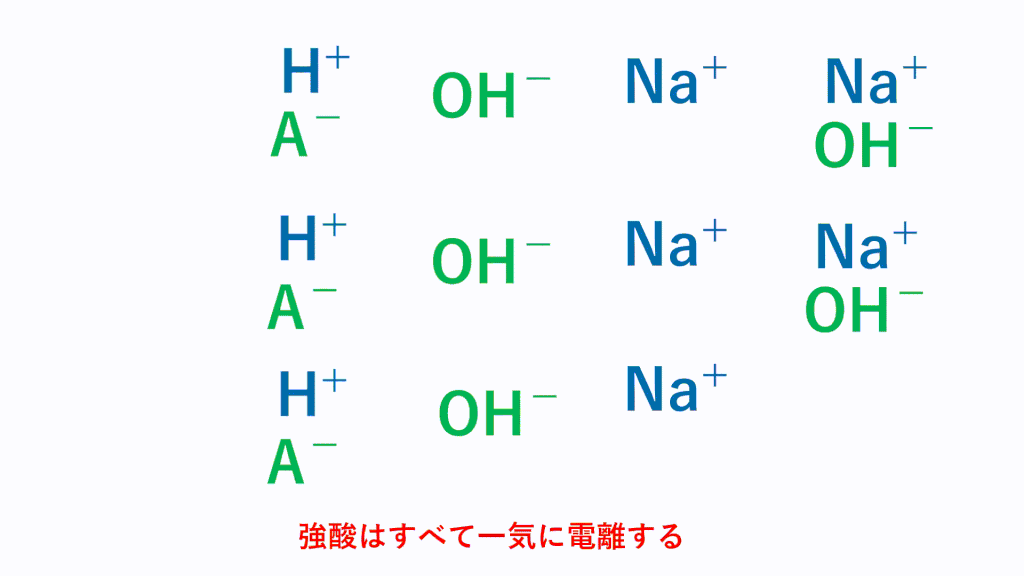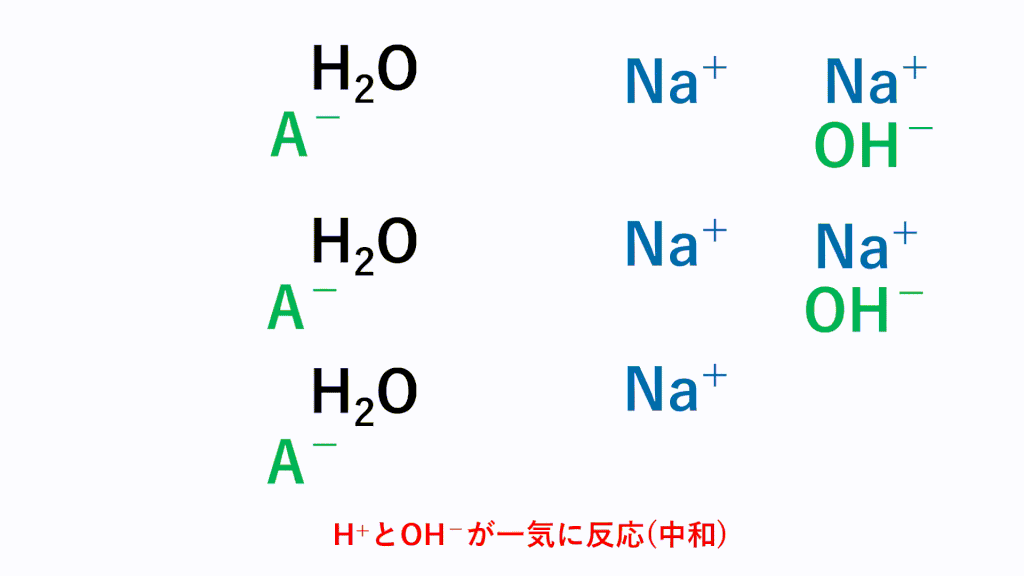
弱酸の場合、常に一部しか電離していません。
しかし、弱酸から電離した水素イオンH+は、塩基のOH-とただちに反応するためH2Oに変化します。
すると、残りの弱酸の一部が再度電離して水素イオンH+を補充します。しかし、塩基のOH-とただちに反応するためH2Oに変化します。
すると、残りの弱酸の一部が再度電離して水素イオンH+を補充します。しかし、塩基のOH-とただちに反応するためH2Oに変化します。
・・・
・・・
と繰り返され、最終的にすべての弱酸が塩基と反応するため、中和の量的関係に強弱は関係ありません。
さいごに
中和の考え方はわかりましたか?最頻出単元のひとつなので、かならず理解しておきましょう。
なお、僕がこれまで1000名以上の個別指導で、生徒の成績に向き合ってきた経験をもとにまとめた化学の勉強法も参考にしてもらえれば幸いです。
また、本記事をググってくださったときのように、参考書や問題集を解いていて質問が出たときに、いつでもスマホで質問対応してくれる塾はこれまでありませんでした。
しかし、2020年より駿台がこの課題を解決してくれるサービスmanaboを開始しました。今のところ塾業界ではいつでも質問対応できるのは駿台だけかと思います。塾や予備校を検討している方の参考になれば幸いです。